题目内容
10.提纯下列物质(括号内是杂质)所用试剂和操作不正确的是( )| A. | CO2(HCl):用NaHCO3饱和溶液洗气 | |
| B. | 植物油(水):萃取 | |
| C. | NaOH溶液(Na2CO3):加入适量的Ca(OH)2溶液 | |
| D. | Cu粉(Fe粉):加入足量稀硫酸溶液后过滤 |
分析 A.HCl与碳酸氢钠反应生成二氧化碳;
B.植物油、水分层;
C.碳酸钠与氢氧化钙反应生成碳酸钙、NaOH;
D.Fe与稀硫酸反应,而Cu不能.
解答 解:A.HCl与碳酸氢钠反应生成二氧化碳,则用NaHCO3饱和溶液洗气可除杂,故A正确;
B.植物油、水分层,选择分液法分离,故B错误;
C.碳酸钠与氢氧化钙反应生成碳酸钙、NaOH,则加入适量的Ca(OH)2溶液、过滤可除杂,故C正确;
D.Fe与稀硫酸反应,而Cu不能,则加入足量稀硫酸溶液后过滤可除杂,故D正确;
故选B.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、发生的反应及混合物分离方法是解本题关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
12.在强酸性溶液中能大量共存的无色透明离子组是( )
| A. | K+、Na+、NO3-、MnO4- | B. | K+、Na+、Cl-、SO42- | ||
| C. | K+、Na+、Cl-、Cu2+ | D. | Na+、Ba2+、OH-、SO42- |
13.下列有关化学用语的表示正确的是( )
| A. | MgCl2与BaO2都是既含有离子键又含有共价键的离子化合物 | |
| B. | 16O2和18O2互为同素异形体 | |
| C. | 氯化氢分子的电子式: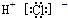 | |
| D. | 质子数为17、中子数为20的氯原子:${\;}_{17}^{37}$Cl |
10.下列反应不能体现乙烯含有不饱和的碳碳双键的是( )
| A. | 乙烯与H2反应 | B. | 乙烯燃烧 | ||
| C. | 乙烯与溴水反应 | D. | 乙烯在催化作用下生成聚乙烯 |
5.MgO可用于制备特种陶瓷,在一定条件下,通过下列反应制备,MgSO4(s)+CO(g)?MgO(s)+CO2(g)+SO2(g)△H>0.上述反应达到平衡后保持其他条件不变,下列说法正确的是( )
| A. | 加入催化剂,反应的△H变大 | B. | 升高温度,混合气体的密度增大 | ||
| C. | 压缩容器,反应吸收的热量不变 | D. | 分离出部分MgO,可增大CO的转化率 |
15.t℃时,某浓度氯化铵溶液的pH=4,下列说法中一定正确的是( )
| A. | 由水电离出的氢离子和氢氧根离子的浓度之比为106:1 | |
| B. | 溶液中c(H+)•c(OH-)=1×10-14 | |
| C. | 溶液中c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 溶液中c(NH3•H2O)+c(NH4+)=c(Cl-)+c(OH-) |
2.下列实验装置正确且能达到相应实验目的是( )
| A. |  配制0.1mol•L-1的NaOH溶液 | B. |  制取NaHCO3 | ||
| C. |  收集乙烯并检验乙烯与溴水的反应 | D. |  证明铁钉析氢腐蚀 |
19.下列解释事实的方程式正确的是( )
| A. | SO2通入Ba(NO3)2溶液中有白色沉淀:SO2+Ba2++H2O=BaSO3↓+2H+ | |
| B. | 0.1mol/L氨水的pH为11:NH3•H2O?NH4++OH- | |
| C. | “84”消毒液和“洁厕灵”(主要成分为盐酸)混合使用会产生有毒气体:ClO3-+5Cl-+6H+=3Cl2+3H2O | |
| D. | 氯化铁溶液中滴加氢硫酸溶液:2Fe3++H2S=2Fe2++S+2H+ |
20.下列分子的立体结构,其中属于直线型分子的是( )
| A. | CH≡CH | B. | H2O | C. | P4 | D. | CH4 |