题目内容
有A、B、C、D四种元素,其原子序数大小关系为A>B>C>D.已知将0.5mol某元素A原子的最高价离子还原成中性原子时,需得到6.02×1023个电子,当A的单质同盐酸充分反应放出0.02g氢气时,用去0.4g A单质.A原子中质子数等于中子数.B元素原子的核外电子层数和A相同.C元素的氧化物既溶于强酸,也溶于强碱.D元素的氢化物为DH3.试回答:
(1)元素符号:B 、C .
(2)C的单质与B的最高价氧化物的水化物溶液反应的化学方程式为 .写出A与盐酸反应的离子方程式为 .
(1)元素符号:B
(2)C的单质与B的最高价氧化物的水化物溶液反应的化学方程式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D四种元素,其原子序数大小关系为A>B>C>D,将0.5mol某元素A原子的最高价离子还原成中性原子时,需得到6.02×1023个电子,说明A显+2价,当A的单质同盐酸充分反应放出0.02g氢气时,则需A为0.01mol,而此时用去A单质的质量为0.4g,则A的相对分子质量为
=40,A原子中质子数等于中子数,所以A为钙元素,C元素的氧化物既溶于强酸,也溶于强碱,则C为铝元素,D元素的氢化物为DH3,原子序数小于C,则D为氮元素,B元素原子的核外电子层数和A相同,且原子序数小于钙,则B为钾元素,据此答题;
| 0.4 |
| 0.01 |
解答:
解:A、B、C、D四种元素,其原子序数大小关系为A>B>C>D,将0.5mol某元素A原子的最高价离子还原成中性原子时,需得到6.02×1023个电子,说明A显+2价,当A的单质同盐酸充分反应放出0.02g氢气时,则需A为0.01mol,而此时用去A单质的质量为0.4g,则A的相对分子质量为
=40,A原子中质子数等于中子数,所以A为钙元素,C元素的氧化物既溶于强酸,也溶于强碱,则C为铝元素,D元素的氢化物为DH3,原子序数小于C,则D为氮元素,B元素原子的核外电子层数和A相同,且原子序数小于钙,则B为钾元素,
(1)根据上面的分析可知,B为钾元素,C为铝元素,
故答案为:K;Al;
(2)铝与氢氧化钾溶液反应的化学方程式为2Al+2KOH+2H2O=2KAlO2+3H2↑,钙与盐酸反应的离子方程式为Ca+2H+=Ca2++H2↑,
故答案为:2Al+2KOH+2H2O=2KAlO2+3H2↑;Ca+2H+=Ca2++H2↑.
| 0.4 |
| 0.01 |
(1)根据上面的分析可知,B为钾元素,C为铝元素,
故答案为:K;Al;
(2)铝与氢氧化钾溶液反应的化学方程式为2Al+2KOH+2H2O=2KAlO2+3H2↑,钙与盐酸反应的离子方程式为Ca+2H+=Ca2++H2↑,
故答案为:2Al+2KOH+2H2O=2KAlO2+3H2↑;Ca+2H+=Ca2++H2↑.
点评:本题主要考查元素及其化合物知识,难度不大,解题关键在于元素的推断,解题时注意熟记常见物质的性质.

练习册系列答案
相关题目
化学与生活密切相关.下列叙述错误的是( )
| A、氧化铁在涂料工业中用作红色防锈颜料 |
| B、铝制餐具不宜用来长时间存放酸性、碱性食物 |
| C、硅胶可用作袋装食品、瓶装药品等的干燥剂 |
| D、二氧化硫具有漂白性,可以用于食品增白 |
下列化学用语表示正确的是( )
| A、质子数、中子数均为1的核素:1H |
| B、漂白粉的有效成分的化学式:CaClO |
C、Cl-的离子结构示意图: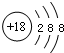 |
| D、碳酸钠的电离方程式:Na2CO3=2Na++CO32- |
下列有关化学用语的表示,正确的是( )
| A、乙烯的结构简式:CH2CH2 |
| B、醛基的结构简式:-COH |
C、丙烷分子的比例模型为: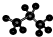 |
D、甲烷的电子式: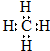 |
下列表述正确的是( )
A、次氯酸的电子式 |
| B、H2O与D2O互为同位素 |
| C、乙醇与二甲醚互为同分异构体 |
| D、CO2、CO、C互为同素异形体 |

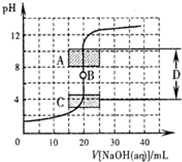 酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法,其间溶液的pH变化是判断滴定终点的依据.
酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法,其间溶液的pH变化是判断滴定终点的依据.