题目内容
体积同为aL的盐酸和K2CO3溶液,将K2CO3溶液逐滴加入盐酸中与盐酸逐滴加入K2CO3溶液中产生的气体体积比为x:y(同温同压,且x≠y).则原K2CO3溶液和盐酸溶液中溶质的物质的量浓度之比为( )
| A、x:y |
| B、(x-2y):x |
| C、2x:(2x-y) |
| D、(2x-y):2x |
考点:化学方程式的有关计算
专题:计算题
分析:将K2CO3溶液逐滴加入盐酸中发生反应:K2CO3+2HCl=2KCl+H2O+CO2↑,盐酸逐滴加入K2CO3溶液中,依次发生反应:K2CO3+HCl=KHCO3+KCl、KHCO3+HCl=KCl+H2O+CO2↑,两个过程产生的二氧化碳不相等,说明第一个过程中盐酸不足,第二个过程中KHCO3有剩余,相同条件下体积之比等于物质的量之比,结合方程式计算K2CO3与HCl的物质的量之比,溶液体积相同,溶液浓度之比等于物质的量之比.
解答:
解:将K2CO3溶液逐滴加入盐酸中发生反应:K2CO3+2HCl=2KCl+H2O+CO2↑,盐酸逐滴加入K2CO3溶液中,依次发生反应:K2CO3+HCl=KHCO3+KCl、KHCO3+HCl=KCl+H2O+CO2↑,两个过程产生的二氧化碳不相等,说明第一个过程中盐酸不足,第二个过程中KHCO3有剩余,
相同条件下,两过程产生的气体体积比为x:y,则量过程中产生二氧化碳物质的量之比为x:y,令产生的二氧化碳分别为xmol、ymol,则:
过程一:K2CO3+2HCl=2KCl+H2O+CO2↑
2xmol xmol
过程二:KHCO3+HCl=KCl+H2O+CO2↑
ymol ymol
K2CO3+HCl=KHCO3+KCl
(2x-y)mol (2x-y)mol
故K2CO3与HCl的物质的量之比=(2x-y)mol:2xmol=(2x-y):2x,溶液体积相同,故K2CO3溶液与盐酸的浓度之比=(2x-y):2x,
故选D.
相同条件下,两过程产生的气体体积比为x:y,则量过程中产生二氧化碳物质的量之比为x:y,令产生的二氧化碳分别为xmol、ymol,则:
过程一:K2CO3+2HCl=2KCl+H2O+CO2↑
2xmol xmol
过程二:KHCO3+HCl=KCl+H2O+CO2↑
ymol ymol
K2CO3+HCl=KHCO3+KCl
(2x-y)mol (2x-y)mol
故K2CO3与HCl的物质的量之比=(2x-y)mol:2xmol=(2x-y):2x,溶液体积相同,故K2CO3溶液与盐酸的浓度之比=(2x-y):2x,
故选D.
点评:本题考查化学方程式的有关计算,关键是明确滴加顺序不同发生的不同反应,难度中等.

练习册系列答案
相关题目
在下列溶液中,各组离子可能大量共存的是( )
| A、PH>7的溶液中:Na+、Cl-、Ba2+、Fe3+ |
| B、存在大量NO3-的溶液中:NH4+、H+、Fe2+、Br- |
| C、碳酸氢钠溶液中:K+、ClO-、Cl-、OH- |
| D、由水电离的c(H+)=10-13mol?L-1的溶液中:Al3+、K+、NO3-、SO42- |
有X、Y、Z、W、M五种原子序数依次增大的短周期主族元素,其中X元素的气态氢化物水溶液显碱性,离子半径Y2->W3+,Y、Z元素的最外层电子数之和等于M元素的最外层电子数.下列说法正确的是( )
| A、X、Y形成的气态氢化物的沸点前者高 |
| B、W、M形成的化合物可作为水处理中的消毒剂 |
| C、工业上通常用电解法制备Z、W、M的单质 |
| D、X、Z形成的化合物ZX3和Z3X所含键的类型相同 |
将1.15g钠投入水中,若使每100个水分子中含有一个钠离子,则需水的量为( )
| A、0.5mol |
| B、5.5mol |
| C、5mol |
| D、5.05mol |
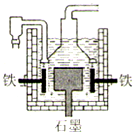 钠是一种重要的金属.工业上制钠的方法有下列三种.其反应原理分别为:
钠是一种重要的金属.工业上制钠的方法有下列三种.其反应原理分别为:Ⅰ:4NaOH(熔融)
| ||
Ⅱ:3Fe+4NaOH═Fe3O4+2H2↑+4Na↑
Ⅲ:3NaCl(熔融)
| ||
下列有关说法正确的是( )
| A、制取等物质的量最的金属钠转移电子的物质的量关系是:Ⅰ=Ⅱ=Ⅲ |
| B、Ⅰ法制钠,阳极发生电极反应为:2OH--2e-=H2↑+O2↑ |
| C、Ⅱ法制钠的原理是利用铁的还原性比钠强 |
| D、Ⅲ法制钠的电解槽装置如图,工作时电解槽的铁电极与电源的负极相连 |
 在如图所示的原电池中,正极发生的反应是( )
在如图所示的原电池中,正极发生的反应是( )| A、2H++2e-═H2↑ |
| B、Cu-2e-═Cu2+ |
| C、Cu2++2e-═Cu |
| D、Zn-2e-═Zn2+ |
若49g H2SO4含有的O原子数为N,则阿佛加德罗常数(NA)等于( )
A、
| ||
B、
| ||
| C、N个 | ||
| D、2N L/mol |