题目内容

(1)实验室常用MnO2与浓盐酸反应制备Cl2(发生装置如图1所示)
①制备实验开始时,先检查装置气密性,接下来的操作依次是
a.往烧瓶中加入MnO2粉末
b.加热
c.往烧瓶中加入浓盐酸
②图2中收集Cl2的正确装置是
③将Cl2通入水中,所得溶液中具有氧化性的含氯离子有
④设计实验比较Cl2和Br2的氧化性,操作与现象是:取少量新制氯水和CCl4于试管中,
(2)能量之间可相互转化:电解食盐水制备Cl2是将电能转化为化学能,而原电池可将化学能转化为电能,设计甲、乙两种类型的原电池,探究其能量转化效率.限选材料:ZnSO4(aq),FeSO4(aq),CuSO4(aq);铜片,铁片,锌片和导线.
①完成原电池甲的装置示意图(见图3),并作相应标注.要求:在同一烧杯中,电极与溶液含相同的金属元素.
②以铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可观察到负极
③甲、乙两种原电池中可更有效地将化学能转化为电能的是
(3)根据牺牲阳极的阴极保护法原理,为减缓电解质溶液中铁片的腐蚀,在(2)的材料中应选
考点:氯气的实验室制法,原电池和电解池的工作原理
专题:实验题,电化学专题
分析:(1)①依据反应物及制取气体的操作步骤分析解答;
②A.装置A的集气瓶的瓶塞为单导气管,无法收集氯气;
B.氯气的密度大于空气,应该采用向上排空气法;
C.氯气密度比空气密度大,需要采用向上排空气法,氯气能够与氢氧化钠溶液反应,可以用氢氧化钠溶液吸收多余的氯气;
D.氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,无法收集氯气.
③氯气和水反应生成盐酸和次氯酸;依据平衡状态各物质性质分析判断;
④溴的四氯化碳显橙红色,氯气有强的氧化性能从溴化钠溶液中置换出溴,反应方程式:Cl2+2NaBr=Br2+2NaCl;
(2)①依据原电池原理和盐桥的作用,在同一烧杯中,电极与溶液含相同的金属元素,设计不同的电极为铜和锌,电解质溶液为硫酸铜和硫酸锌溶液;
②以铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,则另一电极应比铜活泼做负极;
③从电硫稳定,能量转化彻底,反应速率快等分析判断;
(3)牲阳极的阴极保护法原理是原电池中把被保护的金属设计成正极,另一活泼的金属做负极.
②A.装置A的集气瓶的瓶塞为单导气管,无法收集氯气;
B.氯气的密度大于空气,应该采用向上排空气法;
C.氯气密度比空气密度大,需要采用向上排空气法,氯气能够与氢氧化钠溶液反应,可以用氢氧化钠溶液吸收多余的氯气;
D.氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,无法收集氯气.
③氯气和水反应生成盐酸和次氯酸;依据平衡状态各物质性质分析判断;
④溴的四氯化碳显橙红色,氯气有强的氧化性能从溴化钠溶液中置换出溴,反应方程式:Cl2+2NaBr=Br2+2NaCl;
(2)①依据原电池原理和盐桥的作用,在同一烧杯中,电极与溶液含相同的金属元素,设计不同的电极为铜和锌,电解质溶液为硫酸铜和硫酸锌溶液;
②以铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,则另一电极应比铜活泼做负极;
③从电硫稳定,能量转化彻底,反应速率快等分析判断;
(3)牲阳极的阴极保护法原理是原电池中把被保护的金属设计成正极,另一活泼的金属做负极.
解答:
解:(1)①检查装置气密性后,先加入固体,再加入液体:浓盐酸,然后加热;
故答案为:acb;
②A.集气瓶应该用双导气管的瓶塞,无法利用各装置收集氯气,故A错误;
B.氯气的密度大于空气,收集时应该采用向上排空气法,图示装置应该采用短进长出方式,故B错误;
C.氯气密度可以空气,应该使用长进短出的方式收集氯气,氯气能够与氢氧化钠溶液反应,可以用氢氧化钠溶液吸收多余的氯气,故C正确;
D.氢氧化钠溶液能够与氯气发生反应,该装置无法收集到氯气,故D错误;
故答案为:C;
③将Cl2通入水中,发生反应Cl2+H2O=HCl+HClO,次氯酸部分电离成氢离子和次氯酸根离子,所得溶液中具有氧化性的含氯粒子为Cl2、HClO、ClO-;
故答案为:Cl2、HClO、ClO-;
④氯气有强的氧化性能从溴化钠溶液中置换出溴,溴的四氯化碳溶液显橙红色,取少量新制氯水和CCl4于试管中,用胶头滴管向试管中滴加溴化钠溶液、振荡使其充分反应,静置.发现溶液出现分层现象,下层溶液变为橙红色,反应方程式:Cl2+2NaBr=Br2+2NaCl,
故答案为:用胶头滴管向试管中滴加溴化钠溶液、振荡使其充分反应,静置,发现溶液出现分层现象,下层溶液变为橙红色;
(2)①在同一烧杯中,电极与溶液含相同的金属元素,如图示设计原电池,锌做负极,铜做正极,原电池的甲装置示意图为: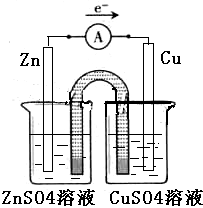
故答案为: ;
;
②以铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,依据原电池反应的原理,需要选用比铜活泼的锌做负极,下层原电池,负极发生氧化反应,Zn-2e-=Zn2+,锌溶解,故答案为:电极逐渐溶解变细;
③甲乙两种原电池中可更有效地将化学能转化为电能的是甲,因为甲可以保持电流稳定,化学能基本都转化为电能.而乙中的活泼金属还可以与CuSO4溶液发生置换反应,部分能量转化为热能,故答案为:甲,甲可以保持电流稳定,化学能基本都转化为电能.而乙中的活泼金属还可以与CuSO4溶液发生置换反应,部分能量转化为热能;
(3)根据牺牲阳极的阴极保护法原理,是原电池原理的应用,利用被保护的金属做正极被保护选择,为减缓电解质溶液中铁片的腐蚀,应选择比铁活泼的金属做负极,在电池内电路为阳极,称为牺牲阳极的阴极保护法,材料中选择锌做阳极,故答案为:锌片.
故答案为:acb;
②A.集气瓶应该用双导气管的瓶塞,无法利用各装置收集氯气,故A错误;
B.氯气的密度大于空气,收集时应该采用向上排空气法,图示装置应该采用短进长出方式,故B错误;
C.氯气密度可以空气,应该使用长进短出的方式收集氯气,氯气能够与氢氧化钠溶液反应,可以用氢氧化钠溶液吸收多余的氯气,故C正确;
D.氢氧化钠溶液能够与氯气发生反应,该装置无法收集到氯气,故D错误;
故答案为:C;
③将Cl2通入水中,发生反应Cl2+H2O=HCl+HClO,次氯酸部分电离成氢离子和次氯酸根离子,所得溶液中具有氧化性的含氯粒子为Cl2、HClO、ClO-;
故答案为:Cl2、HClO、ClO-;
④氯气有强的氧化性能从溴化钠溶液中置换出溴,溴的四氯化碳溶液显橙红色,取少量新制氯水和CCl4于试管中,用胶头滴管向试管中滴加溴化钠溶液、振荡使其充分反应,静置.发现溶液出现分层现象,下层溶液变为橙红色,反应方程式:Cl2+2NaBr=Br2+2NaCl,
故答案为:用胶头滴管向试管中滴加溴化钠溶液、振荡使其充分反应,静置,发现溶液出现分层现象,下层溶液变为橙红色;
(2)①在同一烧杯中,电极与溶液含相同的金属元素,如图示设计原电池,锌做负极,铜做正极,原电池的甲装置示意图为:

故答案为:
 ;
;②以铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,依据原电池反应的原理,需要选用比铜活泼的锌做负极,下层原电池,负极发生氧化反应,Zn-2e-=Zn2+,锌溶解,故答案为:电极逐渐溶解变细;
③甲乙两种原电池中可更有效地将化学能转化为电能的是甲,因为甲可以保持电流稳定,化学能基本都转化为电能.而乙中的活泼金属还可以与CuSO4溶液发生置换反应,部分能量转化为热能,故答案为:甲,甲可以保持电流稳定,化学能基本都转化为电能.而乙中的活泼金属还可以与CuSO4溶液发生置换反应,部分能量转化为热能;
(3)根据牺牲阳极的阴极保护法原理,是原电池原理的应用,利用被保护的金属做正极被保护选择,为减缓电解质溶液中铁片的腐蚀,应选择比铁活泼的金属做负极,在电池内电路为阳极,称为牺牲阳极的阴极保护法,材料中选择锌做阳极,故答案为:锌片.
点评:本题考查了氯气制备方法,气体收集方法,离子检验试验设计,原电池装置设计,盐桥的作用分析应用,金属保护的方法和名称,题目难度中等.

练习册系列答案
相关题目
要使含有Ba2+、Al3+、Cu2+、Mg2+、Ag+等离子的溶液中的各离子逐一形成沉淀析出,下列所选择的试剂及加入试剂的顺序正确的是( )
| A、H2SO4-HCl-H2S-NaOH-CO2 |
| B、HCl-H2SO4-H2S-NaOH-CO2 |
| C、NaCl-Na2SO4-Na2S-NaOH-CH3COOH |
| D、Na2S-Na2SO4-NaCl-NaOH-HCl |
下列实验操作中错误的是( )
| A、蒸发操作时,应残留少许液体,停止加热,再利用余热使水分完全蒸干 |
| B、蒸馏操作时,应使温度计水银球上端与蒸馏烧瓶的支管口下端相平 |
| C、萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
| D、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
 三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如图所示,已知其燃烧热△H=-3677kJ/mol(P被氧化为P4O10),下列有关P4S3的说法中不正确的是( )
三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如图所示,已知其燃烧热△H=-3677kJ/mol(P被氧化为P4O10),下列有关P4S3的说法中不正确的是( )| A、分子中每个原子最外层均达到8电子稳定结构 |
| B、P4S3中硫元素为-2价磷元素为+3价 |
| C、热化学方程式为P4S3(s)+8O2(g)=P4O10(s )+3SO2(g)△H=-3677kJ/mol |
| D、一个P4S3分子中含有三个非极性共价键 |

