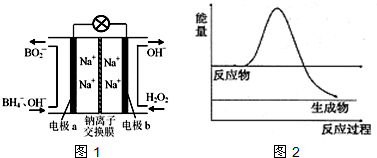
题目内容
NO和NO2通入NaOH溶液中有如下反应:3NO2+2NaOH═2NaNO3+NO+H2O,NO2+NO+2NaOH═2NaNO2+H2O,将m mol NO2和n mol NO通入a mol/L的NaOH溶液,没有气体放出,问所需NaOH溶液的体积最少是多少?
考点:氮的氧化物的性质及其对环境的影响,化学方程式的有关计算
专题:氮族元素
分析:依据反应特征分析,钠元素守恒,氮元素守恒且氮元素物质的量和钠元素物质的量相同,据此计算;
解答:
解:NO和NO2通入NaOH溶液中有如下反应:3NO2+2NaOH═2NaNO3+NO+H2O,NO2+NO+2NaOH═2NaNO2+H2O,没有气体放出,依据元素守恒分析反应特征可知,反应过程中钠元素和氮元素物质的量相同,将m mol NO2和n mol NO通入a mol/L的NaOH溶液,没有气体放出,设所需NaOH溶液的体积最少为x;
m+n=xa
x=
L
答:所需NaOH溶液的体积最少是
L;
m+n=xa
x=
| m+n |
| a |
答:所需NaOH溶液的体积最少是
| m+n |
| a |
点评:本题考查了化学方程式计算应用,主要是元素守恒的分析判断,题目较简单.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案
相关题目
设NA为阿伏加德罗常数的值.下列说法不正确的是( )
| A、常温常压下,13.8g NO2气体溶于足量水,转移电子数为0.2NA |
| B、标准状况下,22.41.CH3CI含有的原子数为5NA |
| C、0.5mo1O2与11.2LO2所含的分子数一定相等 |
| D、常温常压下,14g乙烯与丙烯的混合气体,含碳原子总数为NA |
 的分子式是
的分子式是 .该有机物中所含官能团的名称是
.该有机物中所含官能团的名称是

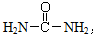 ,请写出尿素的同分异构体中含有离子键的化学式
,请写出尿素的同分异构体中含有离子键的化学式