题目内容
4.常温下,相同物质的量浓度的下列物质的溶液,按PH减小的顺序排列的为( )| A. | NaHSO4 CH3COONa NH4Cl NaNO3 | |
| B. | NaNO3 CH3COONa NaHSO4 NH4Cl | |
| C. | NaNO3 CH3COONa NH4Cl NaHSO4 | |
| D. | CH3COONa NaNO3 NH4Cl NaHSO4 |
分析 先是根据溶液的酸碱性将溶液分为三部分:酸性的、碱性的、中性的,再利用弱离子的水解程度:越弱越水解来比较浓度相同的溶液的pH大小即可.
解答 解:NaHSO4 水溶液中电离出钠离子、氢离子和硫酸根离子,溶液显酸性,CH3COONa是强碱弱酸盐,溶液中醋酸根离子水解溶液显碱性,NH4Cl是强酸弱碱盐,溶液中铵根离子水解显酸性,酸性弱于硫酸氢钠溶液的酸性,NaNO3溶液呈中性,所以溶液PH减小的顺序排列为:CH3COONa、NaNO3、NH4Cl、NaHSO4 ,
故选D.
点评 本题考查了溶液pH的大小比较方法应用,把握离子水解的应用及溶液酸碱性与pH的关系为答的关键,注意酸或是碱越弱,其阴离子水解程度越大,题目难度不大.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案
相关题目
14.下列叙述正确的是( )
| A. | CuSO4•5H2O属于纯净物 | B. | 纯碱、烧碱均属碱 | ||
| C. | 凡能电离出H+的化合物均属酸 | D. | 盐类物质一定含有金属离子 |
15.下列的实验操作不能达到预期目的是( )
①在苯酚溶液中滴入少量稀溴水出现白色沉淀
②配制银氨溶液时,将2%氨水慢慢滴入2%硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
③将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复原来的红色
④将苯和溴水混合后加入铁粉制取溴苯
⑤用乙醇和3%的硫酸共热到170℃制取乙烯.
①在苯酚溶液中滴入少量稀溴水出现白色沉淀
②配制银氨溶液时,将2%氨水慢慢滴入2%硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
③将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复原来的红色
④将苯和溴水混合后加入铁粉制取溴苯
⑤用乙醇和3%的硫酸共热到170℃制取乙烯.
| A. | ①③④ | B. | ②③④ | C. | ①④⑤ | D. | ①②④⑤ |
12.下列关于SO2的说法不正确的是( )
| A. | 将SO2通入紫色石蕊试液中,试液不会褪色 | |
| B. | SO2与Cl2等物质的量混合,可增强漂白效果 | |
| C. | 既有氧化性,又有还原性 | |
| D. | 既可溶于水,又可与水反应 |
9.抗疟疾药物青蒿素可由香茅醛为原料合成.下列有关香茅醛的叙述错误的是( )
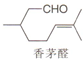

| A. | 分子式是C10H18O | B. | 至少有六个碳原子处于同一平面 | ||
| C. | 能与新制Cu(OH)2悬浊液反应 | D. | 能与H2或Br2发生加成反应 |
16.中华民族有着光辉灿烂的发明史,下列发明创造不涉及化学反应的是( )
| A. | 用蚕丝织丝绸 | B. | 粮食酿酒 | C. | 湿法炼铜 | D. | 人工合成青蒿素 |
13.NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,3.36L氧气与3.2g硫反应,生成SO2分子数为0.1NA | |
| B. | 1L0.1mol?L-1氨水中NH3?H2O分子数为0.1NA | |
| C. | 标准状况下,1.12LCl2发生反应转移的电子数一定为0.1NA | |
| D. | 10g46%酒精(C2H5OH)中含氧原子总数为0.1NA |
13.下列物质中只有在水溶液中才能导电的电解质是( )
| A. | HCl | B. | KOH | C. | SO2 | D. | Cu |
