题目内容
20.下列说法正确的是( )| A. | Li是最活泼金属,加热生成Li2O2 | |
| B. | 16O2与18O2互为同分异构体 | |
| C. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行 | |
| D. | HF、HCl、HBr、HI的酸性逐渐增强 |
分析 A、Li燃烧生成Li2O;
B、16O2与18O2是同种元素形成的不同单质互为同素异形体;
C、元素周期表共18个纵行,16个族,包含7个主族、7个副族、1个第Ⅷ族、1个零族;
D、同主族元素从上到下氢化物的酸性增强.
解答 解:A、Li燃烧生成Li2O,而不是Li2O2,故A错误;
B、16O2与18O2是同种元素形成的不同单质互为同素异形体,故B错误;
C、元素周期表共18个纵行,16个族,包含7个主族、7个副族、1个第Ⅷ族、1个零族,故C错误;
D、同主族元素从上到下氢化物的酸性增强,元素的非金属性逐渐减弱,因此HF、HCl、HBr、HI的酸性逐渐增强,故D正确;
故选D.
点评 本题综合考查元素周期表和元素周期律知识,为高考常见题型和高频考点,注意把握元素周期律的递变规律以及元素的性质与对应化合物的性质的关系,难度不大.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
10.化学与能源开发、环境保护、资源利用、生产生活密切相关.下列说法错误的是( )
| A. | SO2是大气污染物,但葡萄酒中都含有一定量的SO2,SO2既可杀菌又可用来保鲜 | |
| B. | 绿色化学的核心是在化学合成中将原子充分利用,从源头上减少或消除污染 | |
| C. | 茂密树林中的道道光柱,既是一种自然现象又是光学现象,与胶体知识也有关系 | |
| D. | 研发使用高效催化剂,可提高反应中原料的转化率 |
11.甲溶液的pH为4,乙溶液的pH为2,甲溶液与乙溶液的c(H+)之比为( )
| A. | 100 | B. | $\frac{1}{100}$ | C. | 2 | D. | $\frac{1}{2}$ |
8.下列有关离子检验的操作和实验结论都正确的是( )
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入氯化钡溶液,有白色沉淀生成,再加盐酸酸化,沉淀不溶解 | 该溶液中一定含有SO42- |
| B | 向某溶液中加入NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体 | 原溶液中一定含有NH4+ |
| C | 向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色无味气体 | 该溶液中一定含有CO32- |
| D | 用铂丝蘸取某溶液在无色火焰上灼烧直接观察火焰颜色未见紫色 | 原溶液中不含K+ |
| A. | A | B. | B | C. | C | D. | D |
5.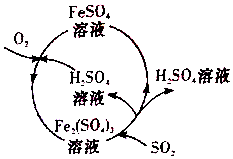 含硫煤燃烧会产生大气污染,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述不正确的是( )
含硫煤燃烧会产生大气污染,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述不正确的是( )
 含硫煤燃烧会产生大气污染,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述不正确的是( )
含硫煤燃烧会产生大气污染,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述不正确的是( )| A. | 该过程中可得到化工产品H2SO4 | |
| B. | 该工艺流程是除去煤燃烧时产生的SO2 | |
| C. | 该过程中化合价发生改变的元素为Fe和S | |
| D. | 图中涉及到的反应之一为Fe2(SO4)3+SO2+2H2O═2FeSO4+2H2SO4 |
9.运用化学反应原理研究卤族元素单质的有关性质具有重要意义.
(1)从淡化海水中提取溴的流程如下:
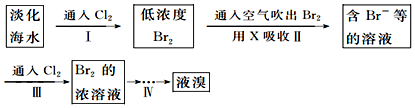
下列有关说法不正确的是C
A.X试剂可用饱和Na2SO3溶液
B.步骤Ⅰ的离子方程式:2Br-+Cl2=2Cl-+Br2
C.工业上每获得1molBr2,需要消耗Cl244.8L
D.步骤Ⅳ包含萃取、分液和蒸馏
(2)ClO2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛.某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究.下面说法不合理的是D
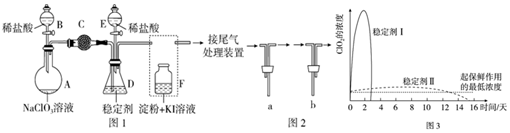
A、打开B的活塞,A中发生反应:2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O,为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜慢.
B、关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是吸收Cl2.
C、已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2.在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是验证是否有ClO2生成
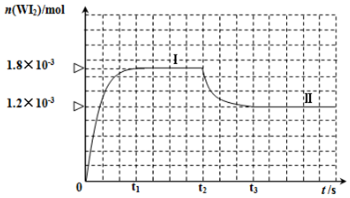
D、已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如图3所示.若将其用于水果保鲜,你认为效果较好的稳定剂是稳定剂I,原因是可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度.(3)常温下,已知25℃时有关弱酸的电离平衡常数:
写出84消毒液(主要成分为NaClO)露置在空气中发生反应的有关化学方程式NaClO+CO2+H2O═HClO+NaHCO3;2HClO $\frac{\underline{\;关照\;}}{\;}$2HCl+O2↑.若将84消毒液与洁厕剂(含有浓盐酸)混合使用可能会导致中毒,请用离子方程式解释有关原因ClO-+Cl-+2H+═Cl2↑+H2O.
(4)服用含碘化钾的碘药片可抗核辐射.将碘药片剥去糖衣皮研碎后置于试管中制得无色水溶液,并加入几滴淀粉试液,然后向试管中逐滴加入氯水,观察到溶液由无色变为蓝色,若继续滴加氯水,蓝色溶液又褪为无色.完成并配平溶液由蓝色变为无色的化学反应方程式(如果化学计量数是1,不用填写):5Cl2+I2+6H2O=2HIO3+10HCl.
(1)从淡化海水中提取溴的流程如下:

下列有关说法不正确的是C
A.X试剂可用饱和Na2SO3溶液
B.步骤Ⅰ的离子方程式:2Br-+Cl2=2Cl-+Br2
C.工业上每获得1molBr2,需要消耗Cl244.8L
D.步骤Ⅳ包含萃取、分液和蒸馏
(2)ClO2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛.某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究.下面说法不合理的是D

A、打开B的活塞,A中发生反应:2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O,为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜慢.
B、关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是吸收Cl2.
C、已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2.在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是验证是否有ClO2生成
D、已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如图3所示.若将其用于水果保鲜,你认为效果较好的稳定剂是稳定剂I,原因是可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度.(3)常温下,已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | HClO | H2CO3 |
| 电离常数 | K=4.7×10-8 | K1=4.3×10-7, |
| K2=5.6×10-11 |
(4)服用含碘化钾的碘药片可抗核辐射.将碘药片剥去糖衣皮研碎后置于试管中制得无色水溶液,并加入几滴淀粉试液,然后向试管中逐滴加入氯水,观察到溶液由无色变为蓝色,若继续滴加氯水,蓝色溶液又褪为无色.完成并配平溶液由蓝色变为无色的化学反应方程式(如果化学计量数是1,不用填写):5Cl2+I2+6H2O=2HIO3+10HCl.
10.化学与材料、生活和环境密切相关.下列说法正确的是( )
| A. | 糖、油脂、蛋白质都可以生水解反应 | |
| B. | 天然纤维、聚酚纤维、光导纤维都属于有机高分子材料 | |
| C. | 大力实施矿物燃料脱硫、脱硝技术以减少硫、氮氧化物排放 | |
| D. | 镀锌铁或镀锡铁镀层破损后仍将通过牺牲阳极的阴极保护法防止腐蚀 |
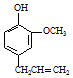 丁子香酚可用于配制康乃馨型香精及制作杀虫剂和防腐剂,结构简式如图.
丁子香酚可用于配制康乃馨型香精及制作杀虫剂和防腐剂,结构简式如图.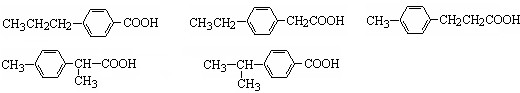 .
.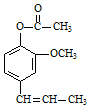 →A$→_{一定条件}^{CH_{3}CH_{2}Cl}$B(C12H16O2)→C(
→A$→_{一定条件}^{CH_{3}CH_{2}Cl}$B(C12H16O2)→C(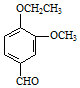 )
)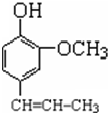 +CH3CH2Cl$\stackrel{一定条件}{→}$
+CH3CH2Cl$\stackrel{一定条件}{→}$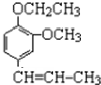 +HCl,反应类型为取代反应.C中滴加少量溴水振荡,主要现象为褪色.
+HCl,反应类型为取代反应.C中滴加少量溴水振荡,主要现象为褪色.