题目内容
18.下列对生产、生活中有关化学问题的分析中,正确的是( )| A. | 镀锌铁制品,镀层破损后铁制品将彻底失去保护 | |
| B. | 由单质A转化为单质B时△H=+119 kJ•mol-1,可知单质B比单质A稳定 | |
| C. | 草木灰与铵态氮肥混合施用效果更好 | |
| D. | Na2CO3可做食用碱,NH4Cl溶液可去除铁锈 |
分析 A.镀锌铁制品破损后,活泼性较强的锌作原电池的负极,活泼性较弱铁作原电池的正极,铁被保护;
B.能量越低越稳定;
C.草木灰显碱性,与铵态氮肥混合会反应产生氨气,降低了施肥效果;
D.Na2CO3水解显碱性,NH4Cl水解显酸性.
解答 解:A.镀锌铁制品破损后,活泼性较强的锌作原电池的负极,活泼性较弱铁作原电池的正极,铁被保护,故A错误;
B.由A转化为B时△H═+119 kJ•mol-1,说明这个过程是吸热反应,反应物能量低,生成物能量高,即B的能量高,能量越低越稳定,A稳定,故B错误;
C.草木灰显碱性,与铵态氮肥混合会反应产生氨气,降低了施肥效果,故C错误;
D.Na2CO3水解显碱性可做食用碱,NH4Cl水解显酸性可去除铁锈,故D正确;
故选D.
点评 本题考查了金属的电化学腐蚀与防护、化学反应与能量、盐类水解的应用,培养了学生化学学科素养,体现了利用化学服务于生活的重要性.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
16.质子数和中子数之和为A,核内中子数为N的R2+离子与16O所形成的Wg氧化物中所含质子的物质的量为( )
| A. | $\frac{W}{A+16}$(A-N+8)mol | B. | $\frac{W}{A+16}$(A-N+10)mol | C. | (A-N+8)mol | D. | $\frac{W}{A+16}$(A-N+6)mol |
6.下列离子的电子层结构相同的一组是( )
| A. | O2-、F-、Na+、Mg2+ | B. | Na+、Mg2+、S2-、Cl- | ||
| C. | F-、Cl-、Br-、I- | D. | Na+、Mg2+、K+、Ca2+ |
13.已知:Fe2+与K3Fe(CN)6反应生成蓝色的KFeFe(CN)6.将FeCl3加入到H2O2溶液中,产生大量气泡,把K3Fe(CN)6溶液滴加到上述溶液中呈现蓝色.下列叙述不正确的是( )
| A. | H2O2既是氧化剂又是还原剂 | |
| B. | FeCl3对H2O2的分解起催化作用 | |
| C. | 使用FeCl2代替FeCl3,不能起到催化作用 | |
| D. | 反应过程中有Fe2+生成 |
3.ClO2是一种消毒杀菌剂,实验室可通过下列反应制得 ClO2:2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O 下列说法正确的是( )
| A. | KClO3在反应中是还原剂 | |
| B. | ClO2是氧化产物 | |
| C. | H2C2O4在反应中被氧化 | |
| D. | 1molKClO3参加反应,有 2mol 电子转移 |
10.下列反应的离子方程式书写正确的是( )
| A. | C12与水反应 C12+H2O═2 H++C1-+ClO- | |
| B. | 稀 H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 少量金属钠放入冷水中:Na+2H2O═Na++2OH-+H2↑ | |
| D. | 碳酸氢钠溶液与足量盐酸反应:HCO3-+H+═H2O+CO2↑ |
7.水的电离平衡曲线如图所示,下列说法不正确的是( )
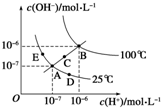

| A. | 图中五点Kw的关系:B>C>A=D=E | |
| B. | 若从A 点到D 点,可采用:温度不变向水中加入少量的酸 | |
| C. | 若从A 点到C 点,可采用:温度不变向水中加入适量的NH4Cl 固体 | |
| D. | 若处在B 点时,将pH=2 的硫酸与pH=10 的KOH 溶液等体积混合后,溶液显中性 |

 N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态