题目内容
3.下列物质中属于弱电解质的是( )| A. | Cu | B. | CO2 | C. | NH4Cl | D. | NH3•H2O |
分析 在水溶液里或熔融状态下能导电的化合物是电解质,包括酸、碱、盐、金属氧化物和水;
在水溶液里和熔融状态下都不导电的化合物是非电解质,包括非金属氧化物、部分非金属氢化物、大多数有机物;
单质和混合物既不是电解质,也不是非电解质;
部分电离的电解质属于弱电解质,完全电离的电解质属于强电解质.
解答 解:A、金属铜为单质,既不是电解质也不是非电解质,故A错误;
B、二氧化碳在水溶液中和熔融状态下均不能导电,故为非电解质,故B错误;
C、氯化铵在水溶液中能完全电离而导电,故为强电解质,故C错误;
D、一水合氨在水溶液中能部分电离而导电,故为弱电解质,故D正确.
故选D.
点评 本题考查了电解质与非电解质、强电解质与弱电解质的判断,题目难度不大,注意掌握电解质与非电解质、强电解质与弱电解质的本质区别,试题能够培养学生灵活应用所学知识的能力.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
13.下列实验操作中正确的是( )
| A. | 分液操作时,先将分液漏斗中的下层液体放出,再将上层液体接着放出 | |
| B. | 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 | |
| C. | 蒸馏实验中温度计的水银球应插入液态混合物中 | |
| D. | 过滤时玻璃棒的末端应轻轻靠在三层滤纸上 |
11.某二元酸(H2A)按如下方式发生一级和二级电离:
H2A=H++HA-
HA-?H++A2-
测得25℃时0.1mol•L-1H2A溶液中c(H+)=0.11mol•L-1,则该条件下,HA-的电离度是( )
H2A=H++HA-
HA-?H++A2-
测得25℃时0.1mol•L-1H2A溶液中c(H+)=0.11mol•L-1,则该条件下,HA-的电离度是( )
| A. | 10% | B. | 9.1% | C. | 1% | D. | 20% |
18.下列各组溶液,只用胶头滴管和试管,不用其它任何试剂就可以鉴别的是( )
①Al2(SO4)3和KOH ②稀盐酸和稀Na2CO3
③NaAlO2和H2SO4 ④Ba(OH)2和NaHCO3.
①Al2(SO4)3和KOH ②稀盐酸和稀Na2CO3
③NaAlO2和H2SO4 ④Ba(OH)2和NaHCO3.
| A. | ① | B. | ①③ | C. | ①②③ | D. | ①②③④ |
8.将1mol SO2和1mol O2通入恒温恒容密闭容器中,一定条件下达到平衡时SO3的物质的量为0.3mol,此时若再加入1mol SO2和1molO2,反应达到新的平衡时,SO3的物质的量是( )
| A. | 0.6 mol | B. | 小于0.6 mol | ||
| C. | 大于0.6 mol | D. | 大于0.3 mol,小于0.6 mol |
15.分子式为C5H10O2,即能和金属钠反应,又能发生银镜反应的有机化合物有多少种(不考虑立体异构)( )
| A. | 10 | B. | 11 | C. | 12 | D. | 13 |
 (不要求立体异构).
(不要求立体异构).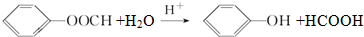 .
.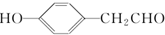 (写结构简式).
(写结构简式). 在人类社会的发展进程中,金属起着重要的作用.
在人类社会的发展进程中,金属起着重要的作用.