题目内容
25℃时pH=13的NaOH溶液与pH=2的H2SO4溶液混合,所得混合液的pH=11,则NaOH溶液与H2SO4溶液的体积比是( )
| A、1:9 | B、1:11 |
| C、9:1 | D、11:1 |
考点:pH的简单计算
专题:计算题
分析:设出氢氧化钠溶液、硫酸的体积,25℃时,pH=13的NaOH溶液中c(OH-)=10-1mol/L,pH=2的H2SO4溶液中c(H+)=10-2mol/L,两溶液混合pH=11,即c(OH-)=10-3mol/L,再结合n=cV表示出n(H+)、n(OH-),最后计算出二者体积之比.
解答:
解:设氢氧化钠溶液和硫酸溶液体积分别为V1和V2,25℃时,pH=13的NaOH溶液中c(OH-)=10-1mol/L,pH=2的H2SO4溶液中c(H+)=10-2mol/L,两溶液混合pH=11,则有混合后溶液中c(OH-)=10-3mol/L=
,V1:V2=1:9,
故选A.
| 10-1mol/LV1-10-2mol/LV2 |
| V1+V2 |
故选A.
点评:本题考查了混合溶液中pH的相关计算,注意酸和碱哪种物质过量的问题,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列装置都可制取氨气,其中药品选用错误的是( )
A、 |
B、 |
C、 |
D、 |
下列关于电解质溶液中离子关系的说法正确的是( )
| A、0.1mol?L-1NaHCO3溶液中离子浓度关系:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) |
| B、0.1mol?L-1NH4Cl和0.1mol?L-1NH3?H2O等体积混合后离子浓度关系:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C、常温下,向醋酸钠溶液中滴加少量醋酸使溶液的pH=7,则混合溶液中:c(Na+)=c(CH3COO-) |
| D、常温下,在pH=1的溶液中,Fe2+、NO3-、ClO-、Na+能大量共存 |
某有机物是药物生产的中间体,其结构简式如图.下列有关叙述正确的是( )


| A、该有机物与溴水可发加成反应 |
| B、该有机物与浓硫酸混合共热可发生消去反应 |
| C、1 mol该有机物与足量NaOH溶液反应最多消耗3 mol NaOH |
| D、该有机物经催化氧化后与新制氢氧化铜悬浊液共热生成砖红色沉淀 |
臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)═N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图象作出的判断正确的是( )
A、 降低温度,平衡向正反应方向移动 |
B、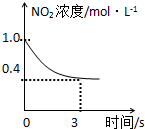 0-3s内,反应速率V (NO2)=0.2 mol?L-1 |
C、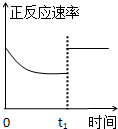 t1时仅加入催化剂,平衡正向移动 |
D、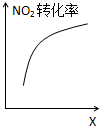 达到平衡时,仅改变X,则X为C(O2) |
通过下列实验现象的分析,对实验事实的解释正确的是( )
| A、向滴有酚酞的Na2CO3溶液中加入BaCl2溶液,溶液褪色,说明BaCl2有酸性 |
| B、H2S能与CuSO4溶液反应生成H2SO4,说明氢硫酸的酸性比硫酸强 |
| C、用玻璃棒蘸取浓氨水点到红色石蕊试纸上,试纸变蓝色,说明浓氨水呈碱性 |
| D、常温下,将铝片放入浓硫酸中,无明显现象,说明铝不与冷的浓硫酸发应 |
氢元素有三种同位素,各有各的丰度.其中
H的丰度指的是( )
1 1 |
A、自然界
| ||
B、
| ||
C、自然界
| ||
D、
|



