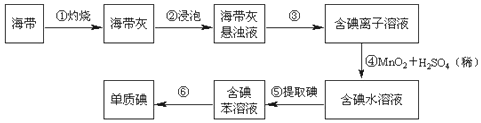
题目内容
11.ngO3和O2的混合气体中含有m个O原子,则阿伏伽德罗常数NA的数值可表示为( )| A. | $\frac{32m}{n}$ | B. | $\frac{16m}{n}$ | C. | $\frac{32n}{m}$ | D. | 无法计算 |
分析 先根据氧气和臭氧的质量和氧元素守恒计算物质的量,n=$\frac{m}{M}$,再根据N=n•NA计算出用m表示的阿伏伽德罗常数.
解答 解:ngO3和O2的混合气体中含有m个O原子,氧元素守恒$\frac{ng}{16g/mol}$=$\frac{m}{{N}_{A}}$,则阿伏伽德罗常数NA的数值可表示为$\frac{16m}{n}$,故选B.
点评 本题考查了阿伏加德罗常数的有关计算,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题充分考查了学生灵活应用所学知识的能力.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
1.已知反应CaCO3 (s)+2HCl(aq)═CaCl2 (aq)+CO2(g)+H2O(l),下列措施可使产生CO2的速率加快的是( )
| A. | 加大CaCO3的量 | B. | 加大盐酸的浓度 | C. | 加大盐酸的量 | D. | 减少CaCl2的浓度 |
6.硫酸铝、硫酸钾、明矾三种物质组成的混合物中,当SO42-的浓度为0.20mol•L-1时,加入等体积的0.20mol•L-1的KOH溶液(混合后溶液体积变化忽略不计),使生成的白色沉淀恰好溶解,那么最后混合物中K+的浓度是( )
| A. | 0.20 mol•L-1 | B. | 0.25 mol•L-1 | C. | 0.225 mol•L-1 | D. | 0.45 mol•L-1 |
3.下列溶液中微粒的物质的量浓度关系正确的是( )
| A. | 0.1mol/LNaHCO3溶液:c(Na+)>c(OH-)>c(HCO3-)>c(H+) | |
| B. | 室温下,向0.01mol/LNH4HSO4溶液中滴加等体积0.01mol/LNaOH溶液:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | Na2CO3溶液:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-) | |
| D. | 25℃时,浓度均为0.1mol/L的CH3COOH和CH3COONa等体积混合:c(CH3COOH)+c(CH3COO-)=0.2mol/L |
20.下列关于含有NH4+溶液的叙述正确的是( )
| A. | 等浓度的下列溶液①(NH4)2CO3、②(NH4)2SO4、③(NH4)2FeSO4 ④NH3•H2O,NH4+浓度大小顺序: ④>③>②>① | |
| B. | PH值相同的①NH4Cl ②(NH4)2SO4 ③NH4HSO4三种溶液中,NH4+浓度大小顺序:③>②>① | |
| C. | 等浓度的①CH3COONH4 ②NH4HCO3 ③(NH4)2CO3PH大小关系:③>②>① | |
| D. | 等浓度等体积NH4Cl与NH3.H2O混合液的物量守恒:c(NH4+)+c(NH3.H2O)=c(Cl-) |
1.下列依据热化学方程式得出的结论正确的是( )
| A. | 等质量的硫磺固体和硫蒸气分别完全燃烧,后者放出的热量多 | |
| B. | △H>0表示放热反应,△H<0表示吸热反应 | |
| C. | △G>0表示反应可自发 | |
| D. | 氢气的燃烧热为285.8kJ/mol,则氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(g),△H=-571.6 kJ/mol |