题目内容
如图为中学化学中几种常见物质的转化关系(部分产物已略去).已知:A、C、D是常见的气体单质,F气体极易溶于水,且液态常做致冷剂.

(1)写出化学式F ,写出电子式G ;
(2)鉴定G中阳离子的实验方法和现象 ;
(3)D单质和E溶液反应,生成一种常见的消毒剂和漂白剂的有效成分,写出D+E溶液反应的离子方程式和③的化学方程式 、 .
(4)工业上电解B溶液制得一系列化工原料,写出其电解的化学方程式, .

(1)写出化学式F
(2)鉴定G中阳离子的实验方法和现象
(3)D单质和E溶液反应,生成一种常见的消毒剂和漂白剂的有效成分,写出D+E溶液反应的离子方程式和③的化学方程式
(4)工业上电解B溶液制得一系列化工原料,写出其电解的化学方程式,
考点:无机物的推断
专题:推断题
分析:A、C、D是常见的气体单质,F气体极易溶于水,且液态常做致冷剂,判断为NH3;B电解生成CDE,可以初步推断是电解氯化钠溶液的产物为H2、Cl2、NaOH,所以C为H2,A为N2,D+F(NH3)=A(N2)+G,能发生反应的只能是D为Cl2,推断G为NH4Cl,G(NH4Cl)+E(NaOH)=B(NaCl)+F(NH3),符合转化关系;依据判断出的物质分析回答问题.
解答:
解:F气体极易溶于水,且液态常做致冷剂,判断为NH3;B电解生成CDE,可以初步推断是电解氯化钠溶液的产物为H2、Cl2、NaOH,所以C为H2,A为N2,D+F(NH3)=A(N2)+G,能发生反应的只能是D为Cl2,推断G为NH4Cl,G(NH4Cl)+E(NaOH)=B(NaCl)+F(NH3);
(1)推断F为:NH3、G是NH4Cl为离子化合物有铵根离子和氯离子构成,电子式为: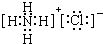 ;
;
故答案为:NH3;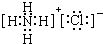 ;
;
(2)鉴定G(NH4Cl)中阳离子为NH4+,取少量氯化铵的溶液加入试管中,用胶头滴管加入少量NaOH浓溶液,加热用湿润的红色石蕊试纸在试管口检验放出的气体,试纸变蓝色,证明含铵根离子;
故答案为:用胶头滴管加入少量NaOH浓溶液,加热用湿润的红色石蕊试纸在试管口检验放出的气体,试纸变蓝色;
(3)D为Cl2;E为NaOH;反应的离子方程式为:2OH-+Cl2=ClO-+Cl-+H2O;③是氨气和氯气发生的氧化还原反应,反应的化学方程式:8NH3+3Cl2
N2+6NH4Cl;
故答案为:2OH-+Cl2=ClO-+Cl-+H2O;8NH3+3Cl2
N2+6NH4Cl;
(4)电解B(NaCl)溶液得到氢氧化钠、氢气、氯气,反应的化学方程式为2NaCl+2H2O
2NaOH+H2↑+Cl2↑;
故答案为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑.
(1)推断F为:NH3、G是NH4Cl为离子化合物有铵根离子和氯离子构成,电子式为:
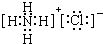 ;
;故答案为:NH3;
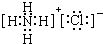 ;
;(2)鉴定G(NH4Cl)中阳离子为NH4+,取少量氯化铵的溶液加入试管中,用胶头滴管加入少量NaOH浓溶液,加热用湿润的红色石蕊试纸在试管口检验放出的气体,试纸变蓝色,证明含铵根离子;
故答案为:用胶头滴管加入少量NaOH浓溶液,加热用湿润的红色石蕊试纸在试管口检验放出的气体,试纸变蓝色;
(3)D为Cl2;E为NaOH;反应的离子方程式为:2OH-+Cl2=ClO-+Cl-+H2O;③是氨气和氯气发生的氧化还原反应,反应的化学方程式:8NH3+3Cl2
| ||
故答案为:2OH-+Cl2=ClO-+Cl-+H2O;8NH3+3Cl2
| ||
(4)电解B(NaCl)溶液得到氢氧化钠、氢气、氯气,反应的化学方程式为2NaCl+2H2O
| ||
故答案为:2NaCl+2H2O
| ||
点评:本题考查了物质转化关系和物质性质的应用,主要考查电解饱和食盐水,氮及其化合物的性质应用,电子式书写方法,离子方程式书写,离子检验方法,题目难度中等.

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A、标准状况下,11.2LNH3和11.2LHCl混合后分子总数为NA |
| B、标准状况下,22.4LSO2与11.2LO2在催化剂作用下反应,一定生成NA个SO3分子 |
| C、标准状况下,在100ml 2mol?L-1H2SO4溶液中加入足量Na2SO3稀溶液,可收集到0.2NA个SO2气体分子 |
| D、1molFe2+ 与足量的H2O2溶液反应,转移NA个电子 |
少量钠应保存在( )
| A、密闭容器中 | B、水中 |
| C、煤油中 | D、四氯化碳中 |
下列四个化学反应中,符合此漫画情景的是( )


| A、H2+CuO═Cu+H2O |
| B、CuO+CO═Cu+CO2 |
| C、Fe+H2SO4=FeSO4+H2↑ |
| D、Fe+CuSO4=FeSO4+Cu |
 化学在能源开发与利用中起着十分关键的作用.
化学在能源开发与利用中起着十分关键的作用.