��Ŀ����
15�� ʵʩ�Լ�����Դ�˷Ѻͽ��ͷ����ŷ�Ϊ�������ݵĽ��ܼ������ߣ���Ӧ��ȫ���������⡢������Դ��Լ�͡������Ѻ������ı�Ȼѡ������ҵ�ķ�չ������Ϲ��ҽ��ܼ��ŵ�����Ҫ����������ѧ֪ʶ������������⣺
ʵʩ�Լ�����Դ�˷Ѻͽ��ͷ����ŷ�Ϊ�������ݵĽ��ܼ������ߣ���Ӧ��ȫ���������⡢������Դ��Լ�͡������Ѻ������ı�Ȼѡ������ҵ�ķ�չ������Ϲ��ҽ��ܼ��ŵ�����Ҫ����������ѧ֪ʶ������������⣺��1����֪ij��Ӧ��ƽ�����ʽΪ��K=$\frac{{C��{H_2}��C��CO��}}{{C��{H_2}O��}}$����������ÿ����3gˮ������������22kJ����������÷�Ӧ���Ȼ�ѧ��ӦΪ��C��s��+H2O��g��
 CO��g��+H2��g����H=+132kJ/mol
CO��g��+H2��g����H=+132kJ/mol��2����֪��һ���¶��£�
C��s��+CO2��g��?2CO��g��ƽ�ⳣ��K1��
CO��g��+H2O��g��?H2��g��+CO2��g��ƽ�ⳣ��K2��
C��s��+H2O��g��?CO��g��+H2��g�� ƽ�ⳣ��K3��
��K1��K2��K3֮��Ĺ�ϵ�ǣ�K3=K1��K2��
��3��ú����ͨ��ͨ���о���ͬ�¶���ƽ�ⳣ���Խ������ʵ�����⣮��֪�������һ����̼��ˮ�������뷴Ӧ��ʱ���ᷢ�����·�Ӧ��CO��g��+H2O��g��?H2��g��+CO2��g�����÷�Ӧƽ�ⳣ�����¶ȵı仯���±���ʾ��
| �¶�/�� | 400 | 500 | 800 |
| ƽ�ⳣ��K | 9.94 | 9 | 1 |
��4���Ӱ����������������ᣬ�˹������漰���������NO��NO2��N2O4�ȣ��Է�ӦN2O4��g��?2NO2��g����H��0���¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ������˵����ȷ����D��
A��A��C����ķ�Ӧ���ʣ�A��C
B��A��C�����������ɫ��A�Cdz
C��B��C����������ƽ����Է���������B��C
D����״̬B��״̬A�������ü��ȵķ���
E��A��C����Ļ�ѧƽ�ⳣ����A��C
��5��0.2mol/L��NaOH��0.4mol/L���������Һ�������Ϻ���Һ�и����ӵ����ʵ���Ũ�ȴӴ�С��˳����c��NO3-����c��NH4+����c��Na+����c��OH-����c��H+����
���� ��1����ƽ�����ʽΪ��K=$\frac{{C��{H_2}��C��CO��}}{{C��{H_2}O��}}$����÷�ӦΪ��C��s��+H2O��g��?CO��g��+H2��g������������1molˮ�������յ�������ע�����ʵľۼ�״̬�뷴Ӧ����д�Ȼ�ѧ����ʽ��
��2����֪����C��s��+CO2��g��?2CO��g��
��CO��g��+H2O��g��?H2��g��+CO2��g��
��C��s��+H2O��g��?CO��g��+H2��g��
��+�ڿɵâۣ���Ӧ�۵�ƽ�ⳣ��Ϊ����ڵ�ƽ�ⳣ��֮����
��3���ɱ������ݿ�֪�����¶�����ƽ�ⳣ����С��˵�������¶�ƽ�������ƶ���
��ƽ��ʱCOŨ�ȱ仯��Ϊxmol/L����ʾ��ƽ��ʱ�����Ũ�ȣ�����ƽ�ⳣ���з��̼�����
��4��N2O4��g���T2NO2��g����H��0���÷�ӦΪ���ȷ�Ӧ�������¶ȣ���ѧƽ�������ƶ���NO2�����������������ѹǿ����ѧƽ�������ƶ���NO2�����������С��
A��A��C�����ڵ������ϣ�ѹǿԽ��Ӧ����Խ�죻
B������ѹǿƽ�����淴Ӧ���У����淴Ӧ�����Ǽ�С����ѹǿ������Ũ���������ƣ�������ƽ���Ա�ԭƽ��Ũ�ȴ�
C��B��C������ͬ���ʵĺ�����ͬ�����������������������������ʵ���֮����ȣ�
D��ѹǿ��ͬ�������¶ȣ���ѧƽ�������ƶ���NO2�������������
E��A��C�����¶���ȣ���ƽ�ⳣ����ͬ��
��5��0.2mol/L��NaOH��0.4mol/L���������Һ�������Ϻõ���Һ�������ơ�����李���ˮ��Ũ����ȣ�һˮ�ϰ��ĵ���̶ȴ���笠�����ˮ��̶ȣ���Һ�ʼ��ԣ�
��� �⣺��1����ƽ�����ʽΪ��K=$\frac{{C��{H_2}��C��CO��}}{{C��{H_2}O��}}$����÷�ӦΪ��C��s��+H2O��g��?CO��g��+H2��g��������1molˮ�������յ�����Ϊ22kJ��$\frac{1mol��18g/mol}{3g}$=132kJ����Ӧ����д�Ȼ�ѧ����ʽΪ����
�ʴ�Ϊ��C��s��+H2O��g�� CO��g��+H2��g����H=+132kJ/mol��
CO��g��+H2��g����H=+132kJ/mol��
�ʴ�Ϊ��C��s��+H2O��g�� CO��g��+H2��g����H=+132kJ/mol��
CO��g��+H2��g����H=+132kJ/mol��
��2����֪����C��s��+CO2��g��?2CO��g��
��CO��g��+H2O��g��?H2��g��+CO2��g��
��C��s��+H2O��g��?CO��g��+H2��g��
��K1=$\frac{{c}^{2}��CO��}{c��C{O}_{2}��}$��K2=$\frac{c��{H}_{2}����c��C{O}_{2}��}{c��CO����c��{H}_{2}O��}$��K3=$\frac{c��CO����c��{H}_{2}��}{c��{H}_{2}O��}$=$\frac{{c}^{2}��CO��}{c��C{O}_{2}��}$��$\frac{c��{H}_{2}����c��C{O}_{2}��}{c��CO����c��{H}_{2}O��}$=K1��K2��
�ʴ�Ϊ��K3=K1��K2��
��3���ɱ������ݿ�֪�����¶�����ƽ�ⳣ����С��˵�������¶�ƽ�������ƶ���������ӦΪ���ȷ�Ӧ��
��ƽ��ʱCOŨ�ȱ仯��Ϊxmol/L����
CO��g��+H2O��g��?H2��g��+CO2��g��
��ʼ��mol/L����0.02 0.02 0 0
�仯��mol/L����x x x x
ƽ�⣨mol/L����0.02-x 0.02-x x x
����$\frac{x��x}{��0.02-x������0.02-x��}$=9�����x=0.015��
����CO��ת����Ϊ$\frac{0.015mol/L}{0.02mol/L}$��100%=75%��
�ʴ�Ϊ�����ȣ�75%��
��3��A����ͼ���֪��A��C�����ڵ������ϣ�C��ѹǿ����A��C����ķ�Ӧ���ʣ�A��C����A����
B��A��C���㶼�ڵ������ϣ�C��ѹǿ����A���C��ƽ�����淴Ӧ���У����淴Ӧ���������ڼ�С�������ѹǿ��ƽ���ƶ��Ľ������NO2Ũ���������ƣ�������ƽ���Ա�ԭƽ��Ũ�ȴ�ƽ��ʱNO2Ũ�ȱ�A��Ũ�ȸߣ�NO2Ϊ����ɫ���壬��A��C�����������ɫ��Adz��C���B����
C��B��C������ͬ���ʵĺ�����ͬ�����������������������������ʵ���֮����ȣ���ƽ����Է���������ȣ���C����
D�������¶ȣ���ѧƽ�������ƶ���NO2���������������ͼ���֪��A��NO2�������������T1��T2����״̬B��״̬A�������ü��ȵķ�������D��ȷ��
E��A��C�����¶���ȣ���ƽ�ⳣ����ͬ����E����
��ѡ��D��
��5��0.2mol/L��NaOH��0.4mol/L���������Һ�������Ϻõ���Һ�������ơ�����李���ˮ��Ũ����ȣ�һˮ�ϰ��ĵ���̶ȴ���笠�����ˮ��̶ȣ���Һ�ʼ��ԣ�����Һ������Ũ�ȴ�СΪ��c��NO3-����c��NH4+����c��Na+����c��OH-����c��H+����
�ʴ�Ϊ��c��NO3-����c��NH4+����c��Na+����c��OH-����c��H+����
���� ���⿼�黯ѧƽ����㡢��ѧƽ��ͼ��ƽ�ⳣ�����Ȼ�ѧ����ʽ��д������Ũ�ȴ�С�Ƚϵȣ��Ƕ�ѧ���ۺ������Ŀ��飬�Ѷ��еȣ�

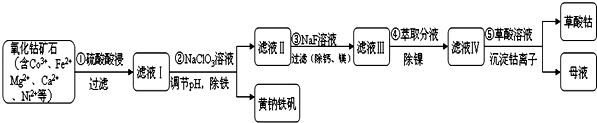
��1����������о���ʯ���ȶ��ܽ����ʵ�Ӱ��������ӱ��з���ѡ���ʯ����Ϊ-200Ŀ��
| ��� | ��ʯ����/Ŀ | �ܽ�����/% |
| 1 | -60 | 9.8 |
| 2 | -120 | 25.5 |
| 3 | -200 | 41.18 |
��3���������NaClO3��Fe2+������Fe3+�����ӷ���ʽ���������ת�Ʒ������Ŀ
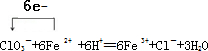 ��
����̽���¶ȶԲ������NaClO3��Fe2+������Fe3+��Ӱ�죬�������ֱ�����20�桢30�桢40���60��ĺ���ˮԡ�У��ⶨc��Fe2+���ı仯�������ͼ�����ͼ�з�������ʵ��¶��£���0s ��120s�ڵ�ƽ����Ӧ����v��Fe2+��=0.25 mol•L-1•min-1��

��4����д������ ���г�ȥþ���ӵ����ӷ�Ӧ����ʽMg2++2F-=MgF2����
��5����Ҫ�����������[Na2 Fe6��SO4��4��OH��12]�к��еĽ���Ԫ�أ������ʵ�鷽����ȡ����������������Һ�ܽ⣬�ֳ����ݣ�һ��������ɫ��Ӧ������Ϊ��ɫ֤����Na+���ڣ���һ�������еμ�KSCN��Һ����Һ���Ѫ��ɫ��֤����Fe3+���ڣ�
��6������ɫ��ѧ�Ƕȷ�����ĸҺ�п�ѭ�����õ�����Ϊ���ᣨ��д���ƣ���
| A�� | ���ʵ��� | B�� | �ܶ� | C�� | ���� | D�� | ���е�ԭ���� |

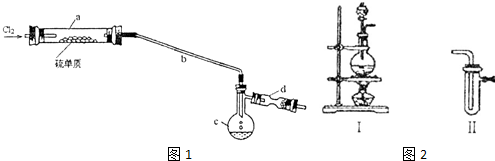
 Һ480mL��
Һ480mL��