题目内容
13.10g碳酸钙与足量盐酸反应,消耗盐酸的物质的量为多少?生成二氧化碳气体的体积(标准状况)为多少?(要求:写出化学反应方程式进行列式计算)分析 发生反应为:CaCO3+2HCl═CaCl2+H2O+CO2↑,根据n=$\frac{m}{M}$计算碳酸钙物质的量,根据方程式计算消耗HCl物质的量、生成二氧化碳物质的量,再根据V=nVm计算二氧化碳的体积.
解答 解:10g碳酸钙物质的量为:n( CaCO3)=$\frac{10g}{100g/mol}$=0.1mol,
设消耗HCl物质的量为x,生成二氧化碳物质的量为y,
CaCO3+2HCl═CaCl2+H2O+CO2↑
1 2 1
0.1mol x y
则:x=$\frac{0.1mol×2}{1}$=0.2mol,y=$\frac{0.1mol×1}{1}$=0.1mol
所以消耗HCl的物质的量为0.2mol,标况下生成二氧化碳的体积为:0.1mol×22.4L/mol=2.24L,
答:消耗HCl的物质的量为0.2mol,标况下生成二氧化碳气体的体积为2.24L.
点评 本题考查了化学方程式的计算,题目难度不大,明确发生反应的实质为解答关键,注意掌握物质的量与摩尔质量、气体摩尔体积之间的关系,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
3.为了探究化学反应中的能量变化,某同学设计了如下两个实验.
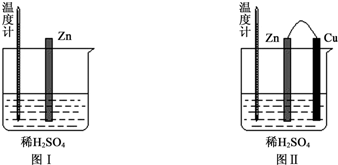
(1)图Ⅰ中发生反应的化学方程式为Zn+2H+═Zn2++H2↑,实验中温度计指示的温度变化及其原因是升高;锌与稀硫酸反应是放热反应.
(2)图Ⅱ实验的实验现象如表,请完成相应实验现象的解释.
(3)若将图中的Cu片替换为Fe片,则Fe片上的电极反应式为2H++2e-=H2↑.

(1)图Ⅰ中发生反应的化学方程式为Zn+2H+═Zn2++H2↑,实验中温度计指示的温度变化及其原因是升高;锌与稀硫酸反应是放热反应.
(2)图Ⅱ实验的实验现象如表,请完成相应实验现象的解释.
| 实验现象 | 解释原因 |
| Cu片上产生了大量气泡 | Zn、Cu构成原电池,H+在Cu片上得电子产生氢气 |
| 温度计指示的温度无明显变化 | 反应中的化学能主要转化成了电能 |
4.在自然界里,既有以游离态又有以化合态的形式存在的元素是( )
| A. | Cl | B. | P | C. | S | D. | Na |
1.下列说法正确的是:(NA表示阿伏加德罗常数的值)( )
| A. | 28g氮气所含有的原子数目为NA | |
| B. | 6g金属镁变成镁离子时失去的电子数目为为NA | |
| C. | 标准状况下,22.4L任何气体所含分子数都约为NA | |
| D. | 50mL 1mol/L NaCl溶液所含的Cl-物质的量0.5NA |
8.下列物质中,易溶于水的是( )
| A. | KNO3 | B. | BaCO3 | C. | AgCl | D. | CuO |
18.下列说法正确的是( )
| A. | c(H+)=1×10-7mol/L的溶液一定是酸性 | |
| B. | 标况时,水本身电离出的c(H+)=1×10-13的溶液,可能是0.1mol•L-1的盐酸或0.1mol•L-1的NaOH溶液 | |
| C. | BaSO4难溶于水,是强电解质 | |
| D. | NH3•H2O的水溶液导电,所以NH3是电解质 |
5.关于3mol NO,下列说法正确的是( )
| A. | 质量为30 g | |
| B. | 含有6.02×1023个NO子 | |
| C. | 标准状况下的体积为67.2L | |
| D. | 与足量氧气完全反应,生成6mol NO2 |


 :CH2=CHCH3、CH2=CH2
:CH2=CHCH3、CH2=CH2 HOCH2CH2OH、
HOCH2CH2OH、 、H2N(CH2)4COOH.
、H2N(CH2)4COOH. .
. .
.