题目内容
11.下列说法正确的是( )| A. | 非极性分子中的原子一定无孤电子对 | |
| B. | 平面三角型分子一定是非极性分子 | |
| C. | 二氯甲烷(CH2Cl2)分子的中心原子是SP3杂化,键角均为109°28′ | |
| D. | ABn型分子的中心原子最外层满足8电子结构,则ABn不一定是非极性分子 |
分析 A.分子中正负电荷中心重合,属于非极性分子,非极性分子中的原子不一定无孤电子对;
B.平面三角型分子,有的是非极性分子,有的不是;
C.甲烷是正四面体,键角均为109°28′,二氯甲烷就是甲烷分子中的两个氢原子被两个氯原子所取代,分子的构型由正四面体变成四面体,键角发生了变化;
D.ABn型分子的中心原子最外层满足8电子结构,ABn有的是非极性分子,有的不是.
解答 解:A.CH4是非极性分子,分子中的原子无孤电子对,CCl4、Al2Cl6两者氯原子都含有孤电子对,故A错误;
B.甲醛中心原子C上无孤电子对,价层电子对数为3,空间构型为平面三角形,碳原子位于三角形内部,结构不对称,所以为极性分子,故B错误;
C.甲烷是正四面体,键角均为109°28′,二氯甲烷分子的构型是四面体,键角发生了变化,不等于109°28′,故C错误;
D.ABn型分子,中心原子最外层满足8电子结构,中心原子的化合价的绝对值等于价电子数,则ABn一定是非极性分子,如CH4,ABn型分子的中心原子最外层仅满足8电子结构,则ABn不一定是非极性分子,如NH3中心原子N为8电子结构,但是分子为极性分子,故D正确;
故选D.
点评 本题考查了分子极性与分子的空间构型关系,注意用枚举法可简化解题的思路,平时注意相关知识的综合应用和特例,题目难度中等,为易错题.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
10. 短周期元素A、B、C、D、E原子序数依次增大.A是周期表中原子半径最小的元素,B原子的最外层电子数等于该元素最低化合价的绝对值,C与D能形成D2C和D2C2两种化合物,而D是同周期中金属性最强的元素,E的负一价离子与C和A形成的某种化合物分子含有相同的电子数.
短周期元素A、B、C、D、E原子序数依次增大.A是周期表中原子半径最小的元素,B原子的最外层电子数等于该元素最低化合价的绝对值,C与D能形成D2C和D2C2两种化合物,而D是同周期中金属性最强的元素,E的负一价离子与C和A形成的某种化合物分子含有相同的电子数.
(1)A、C、D形成的化合物中含有的化学键类型为离子键、共价键.
(2)已知:①E-E→2E•;△H=+a kJ•mol-1
②2A•→A-A;△H=-b kJ•mol-1
③E•+A•→A-E;△H=-c kJ•mol-1(“•”表示形成共价键所提供的电子)写出298K时,A2与E2反应的热化学方程式(用化学式表示)H2(g)+Cl2(g)=2HCl(g)△H=(a+b-2c) kJ•mol-1.
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g)?X(g);△H=-d kJ•mol-1(d>0,X为A、B、C三种元素组成的一种化合物).初始投料与各容器达到平衡时的有关数据如下:
①在该温度下,假设甲容器从反应开始到平衡所需时间为4min,则该时间段内A2的平均反应速率v(A2)=0.125mol/(L.min).
②该温度下此反应的平衡常数K的值为4.
③三个容器中的反应分别达平衡时各组数据关系正确的是ADE(填序号).
A.α1+α2=1 B.α3<α1 C. n2<n3<1.0mol
D.P3<2P1=2P2 E. Q1+Q2=d F.Q3=2Q1
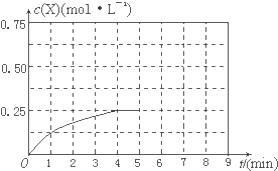
④在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡时A2的总转化率为65.5%,请在图中画出第5min 到新平衡时X的物质的量浓度的变化曲线.
 短周期元素A、B、C、D、E原子序数依次增大.A是周期表中原子半径最小的元素,B原子的最外层电子数等于该元素最低化合价的绝对值,C与D能形成D2C和D2C2两种化合物,而D是同周期中金属性最强的元素,E的负一价离子与C和A形成的某种化合物分子含有相同的电子数.
短周期元素A、B、C、D、E原子序数依次增大.A是周期表中原子半径最小的元素,B原子的最外层电子数等于该元素最低化合价的绝对值,C与D能形成D2C和D2C2两种化合物,而D是同周期中金属性最强的元素,E的负一价离子与C和A形成的某种化合物分子含有相同的电子数.(1)A、C、D形成的化合物中含有的化学键类型为离子键、共价键.
(2)已知:①E-E→2E•;△H=+a kJ•mol-1
②2A•→A-A;△H=-b kJ•mol-1
③E•+A•→A-E;△H=-c kJ•mol-1(“•”表示形成共价键所提供的电子)写出298K时,A2与E2反应的热化学方程式(用化学式表示)H2(g)+Cl2(g)=2HCl(g)△H=(a+b-2c) kJ•mol-1.
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g)?X(g);△H=-d kJ•mol-1(d>0,X为A、B、C三种元素组成的一种化合物).初始投料与各容器达到平衡时的有关数据如下:
| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2molA2、1molBC | 1molX | 4molA2、2molBC |
| 平衡时n(X) | 0.5mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 | α1 | α2 | α3 |
②该温度下此反应的平衡常数K的值为4.
③三个容器中的反应分别达平衡时各组数据关系正确的是ADE(填序号).
A.α1+α2=1 B.α3<α1 C. n2<n3<1.0mol
D.P3<2P1=2P2 E. Q1+Q2=d F.Q3=2Q1
④在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡时A2的总转化率为65.5%,请在图中画出第5min 到新平衡时X的物质的量浓度的变化曲线.
2.下列过程属于人工固氮的是( )
| A. | 用N2和H2合成NH3 | B. | 闪电时大气中氮的氧化物的生成 | ||
| C. | 由氨制尿素 | D. | 从空气中分离出氮气 |
19.下列热化学方程式书写正确的是(△H的绝对值均正确)( )
| A. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol(燃烧热) | |
| B. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=+57.3 kJ/mol(中和热) | |
| C. | S(s)+O2(g)═SO2(g);△H=-296.8 kJ/mol(反应热) | |
| D. | 2NO2═O2+2NO;△H=116.2 kJ/mol(反应热) |
16.将如图所示实验装置的 K 闭合,下列判断正确的是( )
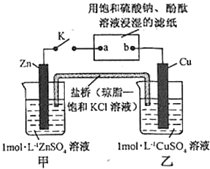

| A. | Cu 电极上发生还原反应 | B. | 电子沿 Zn→a→b→Cu 路径流动 | ||
| C. | 片刻后甲池中 c(SO42-)增大 | D. | 片刻后可观察到滤纸 b 点变红色 |
3.下列关于元素周期表的说法正确的是( )
| A. | 第ⅠA族的元素都是碱金属元素 | |
| B. | 稀有气体元素原子的最外层电子数均为8 | |
| C. | 原子序数为16的元素位于元素周期表的第3周期VIA族 | |
| D. | 第二周期ⅣA族元素的原子核电荷数和中子数一定为6 |
1.铍(Be)为第2周期第IIA族元素,根据它在元素周期表中的位置推测,铍可能具有的性质是( )
| A. | 铍原子的半径小于硼原子的半径 | |
| B. | 相同条件下,单质铍与酸反应比单质锂与酸反应剧烈 | |
| C. | 氢氧化铍的碱性比氢氧化钙的碱性弱 | |
| D. | 单质铍能与冷水剧烈反应 |