题目内容
【题目】苯乙烯(![]() )是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
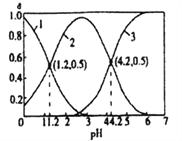
)是生产各种塑料的重要单体,可通过乙苯催化脱氢制得: ![]() ΔH=Q kJ/mol。在实际生产中,常保持总压0.1MPa 不变,并向反应体系中加入稀释剂,如CO2、N2等(不参与反应)。乙苯(EB) 脱氢转化率与反应混合气物质的量之比及反应温度的关系如图所示。下列说法正确的是
ΔH=Q kJ/mol。在实际生产中,常保持总压0.1MPa 不变,并向反应体系中加入稀释剂,如CO2、N2等(不参与反应)。乙苯(EB) 脱氢转化率与反应混合气物质的量之比及反应温度的关系如图所示。下列说法正确的是

A. 相同条件下,正反应速率: v(A) >v(B)
B. 若在恒容条件下加入稀释剂(N2),能增大乙苯的转化率
C. 若A点乙苯的转化率为60%,则混合气体中苯乙烯的37.5 %
D. 用平衡分压来代替平衡浓度计算,其中分压=总压×物质的量分数,则600℃时,B点的平衡常数Kp=0.019MPa
【答案】D
【解析】恒压条件下,充入氮气,容器的体积增大,各物质的浓度减少,速率减慢,所以正反应速率: v(A) <v(B),A错误;若在恒容条件下加入稀释剂(N2),各物质浓度不变,速率不变,平衡不动,乙苯的转化率不变,B错误;假设乙苯为1 mol,消耗0.6 mol,生成苯乙烯0.6 mol,氢气0.6 mol,氮气10 mol,所以混合气体中苯乙烯的百分含量为0.6/(0.4+0.6+0.6+10)=5.2%,C错误;
![]()
起始量 1mol 0 0
变化量 0.4 mol 0.4 0.4
平衡量 0.6 0.4 0.4
分压=总压×物质的量分数,各物质分压分别为:0.1MPa×3/7 、0.1MPa×2/7 、0.1MPa×2/7;平衡常数Kp=(0.1×2/7)×(0.1×2/7)÷(0.1×3/7)=0.019MPa,D正确;正确选项D。

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案【题目】向2L密闭容器中加入1molNO和1mol活性炭,发生反应:2NO(g)+C(s) ![]() N2(g)+CO2(g) △H = -213.5kJ/mol,达到平衡的数据如下:
N2(g)+CO2(g) △H = -213.5kJ/mol,达到平衡的数据如下:
温度/℃ | n(活性炭)/mol | n(CO2)/mol |
T1 | 0.70 | —— |
T2 | —— | 0.25 |
下列说法不正确的是( )
A. 上述信息可推知:T1<T2
B. T1℃时,该反应的平衡常数K=9/16
C. T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率减小
D. T2℃时,若反应达平衡后再缩小容器的体积。c(N2)/c(NO)不变