题目内容
【题目】已知:H2SO3![]() HSO3-+H+ Kal;HSO3-
HSO3-+H+ Kal;HSO3-![]() SO32-+H+ Ka2。25℃时,向某浓度的H2SO3溶液中逐滴滴加一定浓度的NaOH溶液,所得溶液中H2SO3、HSO3-、SO32-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示。下列说法错误的是
SO32-+H+ Ka2。25℃时,向某浓度的H2SO3溶液中逐滴滴加一定浓度的NaOH溶液,所得溶液中H2SO3、HSO3-、SO32-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示。下列说法错误的是
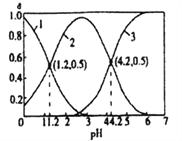
A. 曲线3表示的微粒是SO32-
B. 25℃时,Kal/ Ka2=1000
C. 溶液的pH=1.2时,溶液中有c(Na+)+c(H+)=c(OH-)+c(H2SO3)
D. 溶渡的Ph=4.2时,溶液中有c(Na+)+c(H+)=c(OH-)+2c(SO32-)
【答案】D
【解析】A、由图象可知,溶液pH越大,曲线3表示的离子的物质的量分数逐渐增大,则曲线3表示的微粒是SO32-,选项A正确;B、25℃时,坐标(1.2,0.5)时H2SO3、HSO3-的含量相同,则![]() ,坐标(4.2,0.5)时SO32-、HSO3-的含量相同,则
,坐标(4.2,0.5)时SO32-、HSO3-的含量相同,则![]() ,
, ![]() ,选项B正确;C、溶液的pH=1.2时,此时溶液中的亚硫酸根离子的浓度为0,H2SO3、HSO3-的含量相同浓度相同,而根据电荷守恒可知:c(Na+)+c(H+)=c(OH-)+2c(SO32-)+c(HSO3-),所以c(Na+)+c(H+)=c(OH-)+c(H2SO3),选项C正确;D、溶渡的Ph=4.2时,根据电荷守恒可知:c(Na+)+c(H+)=c(OH-)+2c(SO32-)+c(HSO3-),选项D错误。答案选D。
,选项B正确;C、溶液的pH=1.2时,此时溶液中的亚硫酸根离子的浓度为0,H2SO3、HSO3-的含量相同浓度相同,而根据电荷守恒可知:c(Na+)+c(H+)=c(OH-)+2c(SO32-)+c(HSO3-),所以c(Na+)+c(H+)=c(OH-)+c(H2SO3),选项C正确;D、溶渡的Ph=4.2时,根据电荷守恒可知:c(Na+)+c(H+)=c(OH-)+2c(SO32-)+c(HSO3-),选项D错误。答案选D。

练习册系列答案
相关题目