题目内容
有一瓶澄清溶液,可能含有大量H+、NH
、K+、Mg2+、Ba2+、Al3+、CO
、NO
、Cl-、I-,现进行如下实验:
①测知溶液显强酸性;
②取样加少量四氯化碳和数滴新制氯水,CCl4层为紫红色;
③另取样滴加稀NaOH溶液,使溶液变为碱性,此过程无沉淀生成;加热,有气体放出,
该气体能使湿润的红色石蕊试纸变蓝;
④取少量上述碱性溶液,加Na2CO3溶液出现白色沉淀;
由此可以推断:
(1)溶液中肯定存在的离子有 ;
(2)溶液中不能确定是否存在的离子有 .
(3)写出上述实验②③的离子方程式:② ;③ .
+ 4 |
2- 3 |
- 3 |
①测知溶液显强酸性;
②取样加少量四氯化碳和数滴新制氯水,CCl4层为紫红色;
③另取样滴加稀NaOH溶液,使溶液变为碱性,此过程无沉淀生成;加热,有气体放出,
该气体能使湿润的红色石蕊试纸变蓝;
④取少量上述碱性溶液,加Na2CO3溶液出现白色沉淀;
由此可以推断:
(1)溶液中肯定存在的离子有
(2)溶液中不能确定是否存在的离子有
(3)写出上述实验②③的离子方程式:②
考点:物质的检验和鉴别的实验方案设计
专题:物质检验鉴别题
分析:①测知溶液显强酸性,则在酸性环境下,能和氢离子之间反应的离子不共存;
②取样加少量四氯化碳和数滴新制氯水,CCl4层为紫红色,则是碘单质生成的结果;
③另取样滴加稀NaOH溶液,使溶液变为碱性,此过程无沉淀生成,则和NaOH反应的离子Mg2+、Al3+、Fe3+不共存;加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝,该气体是氨气;
④取少量上述碱性溶液,加Na2CO3溶液出现白色沉淀,该沉淀是碳酸钡沉淀,据此回答判断.
②取样加少量四氯化碳和数滴新制氯水,CCl4层为紫红色,则是碘单质生成的结果;
③另取样滴加稀NaOH溶液,使溶液变为碱性,此过程无沉淀生成,则和NaOH反应的离子Mg2+、Al3+、Fe3+不共存;加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝,该气体是氨气;
④取少量上述碱性溶液,加Na2CO3溶液出现白色沉淀,该沉淀是碳酸钡沉淀,据此回答判断.
解答:
解:①测知溶液显强酸性,一定存在H+,则在酸性环境下,能和氢离子之间反应的离子:CO32-不共存;
②取样加少量四氯化碳和数滴新制氯水,CCl4层为紫红色,则是碘单质生成的结果,一定含有I-,一定不含NO3-;
③另取样滴加稀NaOH溶液,使溶液变为碱性,此过程无沉淀生成,则和NaOH反应的离子Mg2+、Al3+、Fe3+不共存;加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝,该气体是氨气,一定含有NH4+;④取少量上述碱性溶液,加Na2CO3溶液出现白色沉淀,该沉淀是碳酸钡沉淀,一定有Ba2+.
综上:溶液中肯定存在的离子有H+、NH4+、Ba2+、I-,一定不存在的离子有:Mg2+、Al3+、Fe3+、SO42-、CO32-、NO3-,不能确定是否存在的离子有K+、Cl-.
(1)溶液中肯定存在的离子有H+、NH4+、Ba2+、I-,故答案为:H+、NH4+、Ba2+、I-;
(2)溶液中不能确定是否存在的离子有K+、Cl-,故答案为:K+、Cl-;
(3)取样加少量四氯化碳和数滴新制氯水,CCl4层为紫红色,即氯气将碘离子氧化的过程:Cl2+2I-=I2+2Cl-,另取样滴加稀NaOH溶液,加热,有氨气放出,即NH4++OH-
NH3↑+H2O,故答案为:Cl2+2I-=I2+2Cl-;NH4++OH-
NH3↑+H2O.
②取样加少量四氯化碳和数滴新制氯水,CCl4层为紫红色,则是碘单质生成的结果,一定含有I-,一定不含NO3-;
③另取样滴加稀NaOH溶液,使溶液变为碱性,此过程无沉淀生成,则和NaOH反应的离子Mg2+、Al3+、Fe3+不共存;加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝,该气体是氨气,一定含有NH4+;④取少量上述碱性溶液,加Na2CO3溶液出现白色沉淀,该沉淀是碳酸钡沉淀,一定有Ba2+.
综上:溶液中肯定存在的离子有H+、NH4+、Ba2+、I-,一定不存在的离子有:Mg2+、Al3+、Fe3+、SO42-、CO32-、NO3-,不能确定是否存在的离子有K+、Cl-.
(1)溶液中肯定存在的离子有H+、NH4+、Ba2+、I-,故答案为:H+、NH4+、Ba2+、I-;
(2)溶液中不能确定是否存在的离子有K+、Cl-,故答案为:K+、Cl-;
(3)取样加少量四氯化碳和数滴新制氯水,CCl4层为紫红色,即氯气将碘离子氧化的过程:Cl2+2I-=I2+2Cl-,另取样滴加稀NaOH溶液,加热,有氨气放出,即NH4++OH-
| ||
| ||
点评:本题考查了离子检验的实验方法和反应现象分析判断,熟练掌握离子共存的条件及离子性质是解题关键,题目难度中等.

练习册系列答案
相关题目
下列离子反应,表达正确的是( )
| A、向硫酸氢钾溶液中加入Ba(OH)2溶液至pH=7:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
| B、CaCO3与醋酸(CH3COOH)反应:CaCO3+2H+=Ca2++CO2↑+H2O |
| C、向Fe2O3溶液中通入HI:Fe2O3+6H+=2Fe3++3H2O |
| D、MgSO4溶液跟Ba(OH)2溶液反应:SO42-+Ba2+=BaSO4↓ |
不用试剂只用试管和滴管不能鉴别下列无色溶液的是( )
| A、碳酸钠溶液和稀硫酸 |
| B、氯化铝溶液和氢氧化钠溶液 |
| C、四羟基合铝酸钠溶液和稀盐酸 |
| D、氯化钡溶液和碳酸钠溶液 |
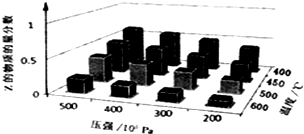 为了探究外界条件对反应aX(g)+bY(g)?cZ(g)的影响,以X和Y物质的量比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.以下判断正确的是( )
为了探究外界条件对反应aX(g)+bY(g)?cZ(g)的影响,以X和Y物质的量比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.以下判断正确的是( )| A、△H>0,a+b>c |
| B、△H>0,a+b<c |
| C、△H<0,a+b>c |
| D、△H<0,a+b<c |
下列分子中所有原子都满足8电子稳定结构的是( )
| A、HClO |
| B、Na2O2 |
| C、BF3 |
| D、PCl5 |
 请回答下列问题.
请回答下列问题.