题目内容
实验室制乙烯时,常因温度过高而发生副反应’生成二氧化硫、二氧化碳、水蒸气和炭黑.请用下列编号为①~⑥的实验装置设计一个实验,以验证上述反应后的混合气中含有二氧化碳、二氧化硫和水蒸气.
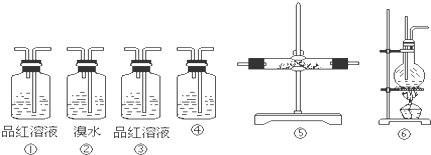
(1)用装置的编号表示其连接顺序(按气体产物从左到右的流向)
(2)装置⑤中的固体药品为 .
(3)装置①中的现象是 ,验证 ; 装置②中溴水的作用是 ,装置③中品红溶液不褪色说明 ; 此时盛有澄清石灰水的装置④中出现 ,可以验证 气体的存在.
写出产生二氧化硫气体的化学反应方程式 .

(1)用装置的编号表示其连接顺序(按气体产物从左到右的流向)
(2)装置⑤中的固体药品为
(3)装置①中的现象是
写出产生二氧化硫气体的化学反应方程式
考点:常见气体的检验
专题:物质检验鉴别题
分析:(1)检验二氧化硫用品红溶液,检验二氧化碳用澄清的石灰水,检验水蒸气用无水硫酸铜,因溶液中有水,所以首先检验水蒸气;因为CO2是用澄清石灰水来检验的,而SO2也可以使澄清石灰水变浑,二氧化硫能使品红褪色,二氧化碳不能,所以,检验二氧化硫在检验二氧化碳之前,再通过澄清石灰水确认CO2存在;
(2)无水硫酸铜和水作用,白色变蓝色;
(3)实验的装置①中装的是品红溶液,当混合气体通过①瓶时,品红褪色,说明产物中有二氧化硫;装置②中的溴水能和二氧化硫反应,用于吸收二氧化硫;装置③由于检验混合气体中的二氧化硫已经除尽,装置④用于检验二氧化碳,若装置③品红溶液不褪色,装置④中澄清石灰水变浑浊,则证明混合气体中含有二氧化碳;乙醇与浓硫酸在加热条件下反应生成二氧化硫、二氧化碳、水蒸气和炭黑.
(2)无水硫酸铜和水作用,白色变蓝色;
(3)实验的装置①中装的是品红溶液,当混合气体通过①瓶时,品红褪色,说明产物中有二氧化硫;装置②中的溴水能和二氧化硫反应,用于吸收二氧化硫;装置③由于检验混合气体中的二氧化硫已经除尽,装置④用于检验二氧化碳,若装置③品红溶液不褪色,装置④中澄清石灰水变浑浊,则证明混合气体中含有二氧化碳;乙醇与浓硫酸在加热条件下反应生成二氧化硫、二氧化碳、水蒸气和炭黑.
解答:
解:(1)实验室制乙烯选用装置⑥;同时乙醇跟浓H2SO4温度过高反应,CH3CH2OH+4H2SO4(浓)
4SO2↑+CO2↑+7H2O+C,因溶液中有水,所以必须先检验水蒸气,选用装置⑤,放入无水硫酸铜,变蓝则说明有水生成;因二氧化碳和二氧化硫都能使澄清的石灰水变浑浊,二氧化硫能使品红褪色,二氧化碳不能,所以用装置①,装置中品红褪色,则说明有SO2气体产生,②装置吸收SO2,③装置品红不褪色,说明吸收完全;最后用装置④,通过澄清石灰水变浑浊,确认CO2存在,
故答案为:⑥⑤①②③④;
(2)装置⑤的作用是检验水蒸气,用白色的无水硫酸铜粉末,CuSO4+5H2O═CuSO4?5H2O变蓝说明混合气体中有水蒸气,
故答案为:无水CuSO4;
(3)装置①盛有品红溶液,用于检验混合气体中含有SO2,品红溶液褪色,证明混合气体中含有二氧化硫;溴水能够与二氧化硫发生反应,从而除去混合气体中的二氧化硫,所以装置②的作用是吸收SO2;装置③用于检验混合气体中的二氧化硫是否除尽,若装置③中二氧化硫不褪色,证明二氧化硫已经除尽;然后将混合气体通入盛有澄清石灰水的装置④,若澄清石灰水变浑浊,则证明混合气体中含有CO2;乙醇与浓硫酸在加热条件下反应生成二氧化硫、二氧化碳、水蒸气和炭黑,其反应的方程式为CH3CH2OH+4H2SO4(浓)
4SO2↑+CO2↑+7H2O+C;
故答案为:品红溶液褪色;混合气体中含有SO2;吸收SO2;二氧化硫已经除尽;澄清石灰水;变浑浊;CO2;CH3CH2OH+4H2SO4(浓)
4SO2↑+CO2↑+7H2O+C.
| ||
故答案为:⑥⑤①②③④;
(2)装置⑤的作用是检验水蒸气,用白色的无水硫酸铜粉末,CuSO4+5H2O═CuSO4?5H2O变蓝说明混合气体中有水蒸气,
故答案为:无水CuSO4;
(3)装置①盛有品红溶液,用于检验混合气体中含有SO2,品红溶液褪色,证明混合气体中含有二氧化硫;溴水能够与二氧化硫发生反应,从而除去混合气体中的二氧化硫,所以装置②的作用是吸收SO2;装置③用于检验混合气体中的二氧化硫是否除尽,若装置③中二氧化硫不褪色,证明二氧化硫已经除尽;然后将混合气体通入盛有澄清石灰水的装置④,若澄清石灰水变浑浊,则证明混合气体中含有CO2;乙醇与浓硫酸在加热条件下反应生成二氧化硫、二氧化碳、水蒸气和炭黑,其反应的方程式为CH3CH2OH+4H2SO4(浓)
| ||
故答案为:品红溶液褪色;混合气体中含有SO2;吸收SO2;二氧化硫已经除尽;澄清石灰水;变浑浊;CO2;CH3CH2OH+4H2SO4(浓)
| ||
点评:本题主要考查了实验室制乙烯以及产物的检验,题目难度中等,当有多种产物需检验时,应考虑先后顺序,注意把握二氧化碳和二氧化硫的性质及其检验方法.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
将9.2g金属钠投入到足量的重水(
H2O)中,则产生的气体中含有( )
2 1 |
| A、0.4 mol中子 |
| B、0.2 mol电子 |
| C、0.2 mol质子 |
| D、0.4 mol分子 |
能正确表示下列分应的离子方程式的是( )
A、实验室制氨气:NH4++OH-
| ||||
| B、向NaHCO3溶液中滴入少量澄清的石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O | ||||
| C、酸性KMnO4溶液与H2O2反应:2MnO4-+3H2O2+6H+═2Mn2++4O2↑+6H2O | ||||
| D、碳酸钙与醋酸反应:CaCO3+2H+═Ca2++H2O+CO2↑ |
用46g乙醇(其中的氧用18),在浓硫酸存在条件下与足量的乙酸充分反应.下列有关叙述中不正确的是( )
| A、生成的水分子中含有18O |
| B、生成的乙酸乙酯中含有18O |
| C、可能生成88g乙酸乙酯 |
| D、不可能生成90g乙酸乙酯 |

 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:
 )的一条路线如下:
)的一条路线如下:
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下: