题目内容
2.等体积的HnRO3和Hn+1RO4两种酸分别与等量的NaOH溶液恰好中和成正盐,则两种酸的物质的量浓度比为( )| A. | 1:1 | B. | n:(n+1) | C. | 1:(n+1) | D. | (n+1):n |
分析 等体积的HnRO3和Hn+1RO4两种酸分别与等量的NaOH溶液恰好中和成正盐,则酸中n(H+)相同,据此分析解答.
解答 解:与定量的NaOH中和都生成正盐,则酸中n(H+)相同,
设这两种酸的物质的量浓度分别为x、y,
可知Vx×n=Vy×(n+1),
解得x:y=(n+1):n,
故选D.
点评 本题考查物质的量浓度的有关计算,为高频考点,明确各个物理量之间的关系是解本题关键,注意酸溶液中c(H+)与酸的浓度及酸的元数的关系,题目难度不大.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
7.下列关于燃料的说法错误的是( )
| A. | 燃料燃烧产物CO2是温室气体之一 | |
| B. | 化石燃料完全燃烧不会造成大气污染 | |
| C. | 以液化石油气代替燃油可减少大气污染 | |
| D. | 燃料不完全燃烧排放的CO是大气污染物之一 |
13.氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2.某同学在实验室中对NH3与NO2反应进行了探究.回答下列问题:
(1)氨气的制备
①氨气的发生装置可以选择上图中的A,反应的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→d→c→f→e→j(按气流方向,用小写字母表示).
(2)氨气与二氧化氮的反应
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好).在一定温度下按图示装置进行实验.

(1)氨气的制备

①氨气的发生装置可以选择上图中的A,反应的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→d→c→f→e→j(按气流方向,用小写字母表示).
(2)氨气与二氧化氮的反应
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好).在一定温度下按图示装置进行实验.

| 操作步骤 | 实验现象 | 解释原因 |
| 打开K1,推动注射器活塞,使X中的气体缓慢充入Y管中 | ①Y管中红棕色气体慢慢变浅 | ②反应的化学方程式 8NH3+6NO2$\frac{\underline{\;催化剂\;}}{\;}$7N2+12H2O |
| 将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝聚 |
| 打开K2 | ③Z中NaOH溶液产生倒吸现象 | ④反应后气体分子数减少,Y管压强小于外压 |
17.常温下,下列四种溶液中,H+浓度之比(①:②:③:④)是( )
①pH=1的醋酸溶液;②0.01mol•L-1的盐酸;③pH=11的氨水;④0.01mol•L-1的NaOH溶液.
①pH=1的醋酸溶液;②0.01mol•L-1的盐酸;③pH=11的氨水;④0.01mol•L-1的NaOH溶液.
| A. | 1:10:100:1000 | B. | 1011:1010:10:1 | C. | 1:10:1010:1011 | D. | 14:13:2:3 |
7.下列各组离子在水溶液中能大量共存的是( )
| A. | H+、OH-、NO3- | B. | Ba2+、H+、SO42- | C. | K+、OH-、CO32- | D. | Fe3+、Cl-、OH- |
2.下列有关500mL0.2mol•L-1氨水的叙述,正确的是( )
| A. | 含有0.1molNH3•H2O | |
| B. | 溶液中NH3的物质的量浓度为0.2mol•L-1 | |
| C. | NH3和NH3•H2O的物质的量浓度之和为0.2mol•L-1 | |
| D. | NH3、NH3•H2O和NH4+的物质的量之和为0.1mol |
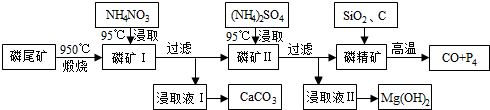
 水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg•L-1.我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5mg•L-1.某化学小组同学设计了下列装置(夹持装置略),测定某河水的DO.
水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg•L-1.我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5mg•L-1.某化学小组同学设计了下列装置(夹持装置略),测定某河水的DO. .
.