题目内容
18.下列有关化学反应的描述中正确的是( )| A. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol | |
| B. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)═2CO(g)+O2(g)反应的△H=+(2×283.0)kJ/mol | |
| C. | 甲烷的燃烧热△H=-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| D. | Mg在CO2中燃烧生成MgO和C,该反应中化学能全部转化为热能 |
分析 A、根据中和热是指稀溶液中,强酸和强碱发生中和反应生成1molH2O所放出的热量判断;
B、根据反应热与反应物的物质的量成正比判断;
C、根据燃烧热是指在101KPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量判断;
D、该反应中部分化学能转化为热能、部分转化为光能.
解答 解:A、中和热是指稀溶液中,强酸和强碱发生中和反应生成1molH2O所放出的热量,则中和热必须是生成1molH2O所放出的热量,与几元酸、碱无关,所以H2SO4和Ca(OH)2反应的中和热仍为△H=-57.3kJ/mol,故A错误;
B、燃烧热是指在101KPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量.CO的燃烧热是283.0kJ/mol,说明1molCO燃烧时放出283.0kJ的能量,在反应方程式2CO2(g)═2CO(g)+O2(g)中,CO的计量数变成2,所以反应热是其燃烧热的2倍,且是吸收能量,故B正确;
C、燃烧热是指在101KPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,气态水不是稳定氧化物,故C错误;
D、Mg在CO2中燃烧生成MgO和C,该反应中部分化学能转化为热能、部分转化为光能,故D错误;
故选:B.
点评 本题考查有关概念,注意:1、中和热的几个关键点:在稀溶液中、强酸强碱反应、生成1molH2O;2、燃烧热的几个关键点:1molH2O、纯物质、稳定氧化物.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.只给出下列甲中和乙中对应的量,不能组成一个求物质的量的公式的是( )
| 序号 | ① | ② | ③ | ④ | ⑤ |
| 甲 | 物质微粒数 | 标准状况下气体摩尔体积 | 固体体积 | 溶液的质量分数 | 非标准状况下物质的质量 |
| 乙 | 阿伏加德罗常数 | 标准状况下气体体积 | 固体密度 | 溶液的体积 | 物质的摩尔质量 |
| A. | ②④ | B. | ④⑤ | C. | ③④ | D. | ③ |
9.如图为某反应的部分微观示意图,其中不同球代表不同元素的原子.下列说法正确的是( )
 +
+ →
→ +4X.
+4X.
 +
+ →
→ +4X.
+4X.| A. | 该反应属于置换反应 | B. | 参加反应的两种分子个数比为1:1 | ||
| C. | 1个X分子中含有3个原子 | D. | 1个X分子中含有3种不同的原子 |
13.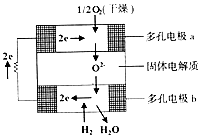 固体氧化物燃料电池是由美国西屋(West-inghouse)公司研制开发的.它以固体氧化锆一氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )
固体氧化物燃料电池是由美国西屋(West-inghouse)公司研制开发的.它以固体氧化锆一氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )
 固体氧化物燃料电池是由美国西屋(West-inghouse)公司研制开发的.它以固体氧化锆一氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )
固体氧化物燃料电池是由美国西屋(West-inghouse)公司研制开发的.它以固体氧化锆一氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )| A. | O2-向电池的正极移动 | |
| B. | 有H2放电的b极为电池的正极 | |
| C. | a极对应的电极反应为O2+2H2O+4e-=4OH- | |
| D. | 该电池的总反应方程式为2H2+O2=2H2O |
3.在浓度均为4mol•L-1的盐酸和硫酸各100mL溶液中,分别加入等质量的铁粉,充分反应后生成气体体积比为2:3,则加入铁粉的质量是( )
| A. | 22.4 g | B. | 16.8 g | C. | 11.2 g | D. | 8.4 g |
10.下列各组离子,能在指定溶液中大量共存的是( )
| A. | 使pH试纸变深蓝色的溶液中:K+、CO32-、Na+、AlO2- | |
| B. | 1.0mol/LKNO3溶液:H+、Fe2+、Cl-、SO42- | |
| C. | 与铝反应产生H2的溶液中:Na+、Mg2+、HCO3-、SO42- | |
| D. | 能使碘化钾淀粉试纸变蓝的溶液中:Na+、NH4+、S2-、I- |
7.常温下,某溶液中水电离出的H+浓度为1×10-13mol•L-1,有关该溶液的说法正确的是( )
| A. | 加入铝粉一定能产生大量H2 | |
| B. | 溶液中OH-的浓度一定为0.1mol•L-1 | |
| C. | 还可能大量存在Na+、NH4+‘Cl-、S2O32- | |
| D. | 通入少量 HCl 气体可能会使溶液中水的电离程度增大 |
