题目内容
18.下列表示对应化学反应的离子方程式正确的是( )| A. | 向AlCl3溶液中滴加过量氨水:Al3++3OH-═Al(OH)3↓ | |
| B. | 向NaNO2溶液中滴加酸性KMnO4溶液:5NO2-+2MnO4-+3H2O═5NO3-+2Mn2++6OH- | |
| C. | 醋酸除去水垢中的CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 向偏铝酸钠溶液中通入过量的CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
分析 A.一水合氨在离子反应中保留化学式;
B.酸性溶液中不能生成氢氧根离子;
C.醋酸在离子反应中保留化学式;
D.反应生成氢氧化铝和碳酸氢钠.
解答 解:A.向AlCl3溶液中滴加过量氨水的离子反应为Al3++3NH3.H2O═Al(OH)3↓+3NH4+,故A错误;
B.向NaNO2溶液中滴加酸性KMnO4溶液的离子反应为5NO2-+2MnO4-+6H+═5NO3-+2Mn2++3H2O,故B错误;
C.醋酸除去水垢中的CaCO3的离子反应为CaCO3+2CH3COOH═2CH3COO-+Ca2++H2O+CO2↑,故C错误;
D.向偏铝酸钠溶液中通入过量的CO2的离子反应为AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、复分解反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
相关题目
8.下列离子方程式书写正确的是( )
| A. | 氢氧化铁溶于氢碘酸中$Fe{(OH)_3}+3{H^+}=F{e^{3+}}+3{H_2}O$ | |
| B. | 次氯酸钙溶液中通入过量的二氧化碳Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO | |
| C. | 向100mL 0.1moL/L的溴化亚铁溶液中通入0.015 mol的氯气$2F{e^{2+}}+4B{r^-}+3C{l_2}=2F{e^{3+}}+2B{r_2}+6C{l^-}$ | |
| D. | 向明矾溶液逐滴加入氢氧化钡溶液至铝离子刚好完全沉淀$A{l^{3+}}+S{O_4}^{2-}+B{a^{2+}}+3O{H^-}=BaS{O_4}↓+Al{(OH)_3}↓$ |
9.以下物质:(1)甲烷;(2)苯;(3)聚乙烯;(4)2-丁炔;(5)环己烷;(6)邻二甲苯;(7)苯乙烯.既能使KMnO4酸性溶液褪色,又能使溴水因发生化学反应而褪色的是( )
| A. | (3)(4)(5) | B. | (4)(5)(7) | C. | (4)(7) | D. | (3)(4)(5)(7) |
6.设NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1.0 L 1.0 mol•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 23 g Na与足量H2O反应完全后可生成NA个H2分子 | |
| C. | 标准状况下,11.2 L CH3CH2OH中含有的分子数目为0.5NA | |
| D. | 常温常压下,46 g的NO2与N2O4混合物含有的原子数为3 NA |
13.2014年7月31日中国经济网:河北省开展“环保亮剑”专项整治行动,强化“三废”治理.某工厂废渣的主要成分为SiO2、MgO、Al2O3、Fe2O3等成分,回收废渣中的金属元素的工艺流程如图所示:
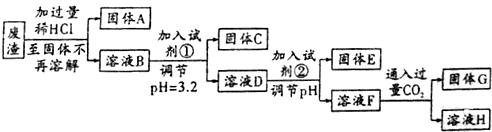
己知:常温下,饱和氨水的pH约为11,金属离子沉淀所需pH数据如表所示:
(1)试剂①为C,试剂②为B;
A.AgNO3 B.NaOH C.NH3•H2O D.H2SO4
(2)固体C的化学式是Fe(OH)3,溶液F中金属元素的存在形式为AlO2-、Na+;
(3)写出固体A与试剂②反应的化学方程式:SiO2+2NaOH=Na2SiO3+H2O;F中通入过量CO2所发生的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)加入试剂②,实现溶液D到溶液F的转化,则调节溶液的pH为D.
A.6 B.10 C.12 D.13
(5)25℃时,按(4)调节pH后测得溶液F中c(Mg2+)=5.6×10-10mol/L,则氢氧化镁的Ksp=5.6×10-12;
(6)最后一步反应中涉及到两种盐,其中酸式盐的溶液中各离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-).

己知:常温下,饱和氨水的pH约为11,金属离子沉淀所需pH数据如表所示:
| 离子 | 以氢氧化物形式完全沉淀时所需pH | 氢氧化物沉淀完全溶解时所需pH |
| Fe3+ | 3.2 | |
| A13+ | 5.3 | 11.9 |
| Mg2+ | 12.3 |
A.AgNO3 B.NaOH C.NH3•H2O D.H2SO4
(2)固体C的化学式是Fe(OH)3,溶液F中金属元素的存在形式为AlO2-、Na+;
(3)写出固体A与试剂②反应的化学方程式:SiO2+2NaOH=Na2SiO3+H2O;F中通入过量CO2所发生的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)加入试剂②,实现溶液D到溶液F的转化,则调节溶液的pH为D.
A.6 B.10 C.12 D.13
(5)25℃时,按(4)调节pH后测得溶液F中c(Mg2+)=5.6×10-10mol/L,则氢氧化镁的Ksp=5.6×10-12;
(6)最后一步反应中涉及到两种盐,其中酸式盐的溶液中各离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-).
3.能在水溶液中大量共存的一组离子是( )
| A. | H+、Fe2+、I-、NO3- | B. | Al3+、AlO2-、SO42-、Cl- | ||
| C. | K+、Ag+、Ca2+、NO3- | D. | NH4+、Na+、OH-、MnO4- |
10.下列关于SiO2和金刚石的叙述正确的是( )
| A. | SiO2晶体结构中,每个Si原子与2个O原子直接相连 | |
| B. | 通常状况下,60gSiO2晶体中含有的分子数为NA(NA表示阿伏加德罗常数) | |
| C. | 12g金刚石含4molC-C键 | |
| D. | 金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子 |
8. 实验探究是学习化学的一个重要方法,某实验小组的同学利用下列装置完成一些常见气体制备以及相关物质性质探究(夹持装置及连接橡胶管已省略,其中装置E有多个供使用).
实验探究是学习化学的一个重要方法,某实验小组的同学利用下列装置完成一些常见气体制备以及相关物质性质探究(夹持装置及连接橡胶管已省略,其中装置E有多个供使用).
可供选择的液体试剂及固体药品:
请回答下列问题:
(1)已知氨气和氯气在常温下可以发生氧化还原反应,A、B分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气的反应装置,则仪器的连接顺序是A→D→C←E←E←B.
(2)完成上述实验需选用仪器D和E,D中选用e,E中选用c、f(填写序号).
a.无水氯化钙 b.饱和碳酸氢钠溶液 c.饱和食盐水
d.五氧化二磷 e.碱石灰 f.浓硫酸
(3)C内出现大量白烟,另一种生成物常用作食品包装袋内的保护气,请写出反应的化学方程式3Cl2+8NH3=6NH4Cl+N2.
(4)请你利用所学化学知识设计一个实验方案检验白烟物质中的离子将白烟配成水溶液取适量于试管中,先用硝酸酸化,加入硝酸银有白色沉淀说明有Cl-,再取一份加入过量氢氧化钠,加热产生有刺激性气味气体,能使湿润的红色石蕊试纸变蓝说明有NH4+.
 实验探究是学习化学的一个重要方法,某实验小组的同学利用下列装置完成一些常见气体制备以及相关物质性质探究(夹持装置及连接橡胶管已省略,其中装置E有多个供使用).
实验探究是学习化学的一个重要方法,某实验小组的同学利用下列装置完成一些常见气体制备以及相关物质性质探究(夹持装置及连接橡胶管已省略,其中装置E有多个供使用).可供选择的液体试剂及固体药品:
| 液体试剂 | 固体药品 |
| 稀硫酸、稀盐酸、稀硝酸、NaOH溶液、浓氨水、5%H2O2溶液、浓盐酸、饱和食盐水 | CaCO3、CaO、MnO2、KMnO4、 碱石灰、Cu、Zn、Na2S |
(1)已知氨气和氯气在常温下可以发生氧化还原反应,A、B分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气的反应装置,则仪器的连接顺序是A→D→C←E←E←B.
(2)完成上述实验需选用仪器D和E,D中选用e,E中选用c、f(填写序号).
a.无水氯化钙 b.饱和碳酸氢钠溶液 c.饱和食盐水
d.五氧化二磷 e.碱石灰 f.浓硫酸
(3)C内出现大量白烟,另一种生成物常用作食品包装袋内的保护气,请写出反应的化学方程式3Cl2+8NH3=6NH4Cl+N2.
(4)请你利用所学化学知识设计一个实验方案检验白烟物质中的离子将白烟配成水溶液取适量于试管中,先用硝酸酸化,加入硝酸银有白色沉淀说明有Cl-,再取一份加入过量氢氧化钠,加热产生有刺激性气味气体,能使湿润的红色石蕊试纸变蓝说明有NH4+.