题目内容
14.NA表示阿伏加德罗常数,下列有关叙述正确的是( )| A. | 6.2g氧化钠和7.8g过氧化钠的混合物中含有的离子总数为0.6NA | |
| B. | 1mol铁粉在1mol氯气中充分燃烧,失去的电子数为3NA | |
| C. | 高温下,16.8 g Fe与足量水蒸气完全反应失去0.9NA个电子 | |
| D. | 等体积、浓度均为1mol•L-1的磷酸和盐酸,电离出的氢离子数之比为3:1 |
分析 A.1mol氧化钠、过氧化钠中都含有2mol钠离子、1mol阴离子,根据n=$\frac{m}{M}$计算出氧化钠和过氧化钠的物质的量,然后计算出含有的总离子数;
B.1mol铁与氯气完全反应消耗1.5mol氯气,氯气不足,转移电子按照氯气的量计算;
C.铁与水蒸气反应生成的是四氧化三铁,根据n=$\frac{m}{M}$计算出铁的物质的量,然后根据电子守恒计算出转移电子的物质的量;
D.磷酸为弱电解质,则磷酸电离出的氢离子物质的量减少.
解答 解:A.6.2g氧化钠的物质的量为:$\frac{6.2g}{62g/mol}$=0.1mol,7.8g过氧化钠的物质的量为:$\frac{7.8g}{78g/mol}$=0.1mol,0.1mol氧化钠中含有0.2mol钠离子、0.1mol氧离子,0.1mol过氧化钠中含有0.2mol钠离子、0.1mol过氧根离子,所以混合物中含有离子的总物质的量为:0.6mol,含有的离子总数为0.6NA,故A正确;
B.1molFe完全反应消耗1.5mol氯气,氯气不足,则该反应中转移电子的物质的量为1mol×2=2mol,失去的电子数为2NA,故B错误;
C.Fe与水蒸气加热反应生成四氧化三铁,四氧化三铁中的平均化合价为+$\frac{8}{3}$价,16.8g铁的物质的量为:$\frac{16.8g}{56g/mol}$=0.3mol,转移电子的物质的量为:0.3mol×($\frac{8}{3}$-0)=0.8mol,反应失去0.8NA个电子,故C错误;
D.等体积、浓度均为1mol•L-1的磷酸和盐酸,磷酸为弱电解质,盐酸为强酸,则二者电离出的氢离子数之比小于3:1,故D错误;
故选A.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,C为易错点,转移铁与水蒸气反应生成的是四氧化三铁,试题培养了学生的分析能力及化学计算能力.

| A. | 质子数=核电荷数 | B. | 相对原子质量=质子数+中子数 | ||
| C. | 质子数≠中子数 | D. | 质子数=核外电子数 |
| A. | 15N与14N互为同位素 | B. | 13C与C60互为同位素 | ||
| C. | 13C与15N有相同的中子数 | D. | 15N的核外电子数与中子数相同 |
| A. | pH=3的 NH4Cl溶液与pH=3的盐酸中,水电离的c(H+)相等 | |
| B. | 25℃时将0.1mol•L-1 的HF加水不断稀释,$\frac{c({H}^{+})•c({F}^{-})}{c(HF)}$不变 | |
| C. | K2SO3溶液中加入少量NaOH固体,溶液的pH增大,SO32-水解程度减小 | |
| D. | pH=5的CH3 COOH 与CH3COONa混合溶液中,c(CH3COO-)<c(Na+) |
| A.目的:浓度对化学反应速率的影响 | B.目的:配制银氨溶液 |
加入 1mol/L 1mL硫酸 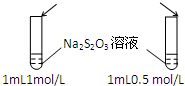 | 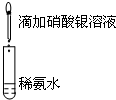 |
| C.目的:比较Al、Fe、Cu活动性 | D.目的:实验室制取氨气 |
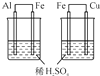 |  |
| A. | A | B. | B | C. | C | D. | D |

| A. | 取代反应 | B. | 加成反应 | C. | 聚合反应 | D. | 加聚反应 |
 ,
, .
.


 ,反应类型为加成反应.
,反应类型为加成反应. .
.