题目内容
17.下列关于化学用语的表述正确的是( )| A. | 丙烷分子的球棍模型: | B. | S的结构示意图为 | ||
| C. | HClO的结构式为H-Cl-O | D. | 碳-14核素:814C |
分析 A.丙烷分子中含有2个甲基、1个亚甲基,碳原子的原子半径大于氢原子;
B.硫原子的核电荷数=核外电子总数=16,最外层含有6个电子;
C.次氯酸的中心原子为O,分子中不存在H-Cl键;
D.碳原子的质子数为6,元素符号的左下角为质子数.
解答 解:A.丙烷为含有3个C的烷烃,碳原子的原子半径较大,其球棍模型为: ,故A正确;B.硫原子的核外电子总数为18,最外层含有6个电子,其原子结构示意图为:
,故A正确;B.硫原子的核外电子总数为18,最外层含有6个电子,其原子结构示意图为: ,故B错误;
,故B错误;
C.HClO分子中含有1个H-O键和1个O-Cl键,其正确的结构式为:H-O-Cl,故C错误;
D.碳原子的质子数为6,碳-14核素的正确表示方法为:614C,故D错误;
故选A.
点评 本题考查了常见化学用语的表示方法,题目难度不大,涉及原子结构示意图、球棍模型、结构式、元素符号等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.

练习册系列答案
 互动英语系列答案
互动英语系列答案
相关题目
8.下列溶液中,溶质的物质的量浓度为0.1mol/L的是( )
| A. | 1L溶液中含有4g NaOH | B. | 1L水中溶解4gNaOH | ||
| C. | 0.5L溶液中含有0.2mol H2SO4 | D. | 9.8g H2SO4溶于1L水配成溶液 |
5.将0.3mol•L-1的NaCl溶液100mL和0.1mol•L-1的AlCl3溶液400mL混合后,其混合溶液中c(Cl-)为( )
| A. | 0.1 mol•L-1 | B. | 0.2 mol•L-1 | C. | 0.3 mol•L-1 | D. | 0.4 mol•L-1 |
12.有机物X的蒸气相对氢气的密度为51,X中氧元素的质量分数为31.4%,则能在碱性溶液中发生反应的X的同分异构体有(不考虑立体异构)( )
| A. | 15种 | B. | 14种 | C. | 13种 | D. | 12种 |
2.如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法或表示式正确的是( )
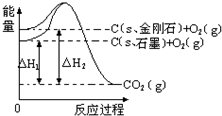

| A. | 石墨和金刚石的转化是物理变化 | |
| B. | C(s、石墨)=C(s、金刚石)△H=+1.9 kJ•mol-1 | |
| C. | 金刚石的稳定性强于石墨 | |
| D. | 1 mol石墨的总键能比1 mol金刚石的总键能小 |
6.若20g密度为ρg•cm-3的硝酸钙溶液里含1gCa2+,则NO3-的物质的量浓度是( )
| A. | 400ρmol•L-1 | B. | 20ρmol•L-1 | C. | 2.5ρmol•L-1 | D. | 1.25ρmol•L-1 |
3.下列关于化学试剂的保存方法不正确的是( )
| A. | 硝酸见光易分解,故需保存在棕色瓶中 | |
| B. | Na2CO3、NaAlO2溶液显碱性,故只能用橡胶塞保存 | |
| C. | FeCl2溶液保存时需加入少量铁粉和盐酸 | |
| D. | 少量白磷可保存在煤油中 |
 (足量)
(足量) +4H2$\stackrel{催化剂}{→}$
+4H2$\stackrel{催化剂}{→}$ .
.