题目内容
7.下列物质中,属于强电解质的是( )| A. | 氨水 | B. | 硫酸 | C. | 乙酸 | D. | 葡萄糖 |
分析 在水溶液里或熔融状态下能导电的化合物是电解质,在水溶液和熔融状态下都不能导电的化合物属于非电解质,在水溶液里全部电离的是强电解质,部分电离属于弱电解质,电解质属于化合物,据此解答即可.
解答 解:A.氨水为混合物,不是电解质,故A错误;
B.硫酸在水溶液中能完全电离而导电的化合物,属于强电解质,故B正确;
C.乙酸在水溶液中只能部分电离,属于弱电解质,故C错误;
D.葡萄糖在水溶液和熔融状态下都不能导电,属于非电解质,故D错误;
故选:B.
点评 本题考查了强弱电解质的判断,把握电解质的定义,分清强弱电解质的本质区别,注意混合物既不是电解质也不是非电解质,题目难度不大.

练习册系列答案
相关题目
17.高铁酸盐在能源、环保等方面有着广泛的用途.工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示,则下列说法不正确的是( )
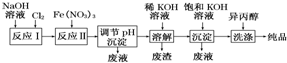

| A. | 反应Ⅰ主要为2NaOH+Cl2═NaCl+NaClO+H2O 反应Ⅱ的离子方程式为3ClO-+10OH-+2Fe3+═2FeO42-+3Cl-+5H2O | |
| B. | 加入饱和KOH溶液的目的是增大K+浓度,促进K2FeO4晶体析出 | |
| C. | 调节pH析出的沉淀为高铁酸钠,用异丙醇洗涤的主要目的是有利于产品干燥 | |
| D. | 高铁酸钾是一种理想的水处理剂,其处理水的原理为高铁酸钾有强氧化性,能杀菌消毒,产生的Fe(OH)3有吸附性,有絮凝作用 |
18.下列溶液中各微粒的浓度关系不正确的是( )
| A. | 0.1mol•L-1 CH3COOH溶液中:c(CH3COO-)+c(OH-)=c(H+) | |
| B. | 1 L0.l mol•L-1CuSO4•(NH4)2SO4•6H2O的溶液中:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-) | |
| C. | 0.1mol•L-1NaHCO3溶液中:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) | |
| D. | 等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(X-)>c(H+)>(OH-) |
15.现有下列8种物质:
①Cl2 ②铜 ③CaO ④CO2
⑤Ba(OH)2 ⑥淀粉溶液 ⑦HClO ⑧浓硫酸
(1)把上述各物质按物质的分类方法填写在表格的空白处(填物质编号):
(2)在标准状况下,相同体积的①和④,其原子个数比为2:3.
(3)⑤在水中的电离方程式为Ba(OH)2=Ba2++2OH-.
(4)②与⑧发生反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
该反应中氧化剂和还原剂的物质的量之比为1:1.
①Cl2 ②铜 ③CaO ④CO2
⑤Ba(OH)2 ⑥淀粉溶液 ⑦HClO ⑧浓硫酸
(1)把上述各物质按物质的分类方法填写在表格的空白处(填物质编号):
| 分类标准 | 碱性氧化物 | 非电解质 | 弱酸 | 胶体 |
| 属于该类的物质 |
(3)⑤在水中的电离方程式为Ba(OH)2=Ba2++2OH-.
(4)②与⑧发生反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
该反应中氧化剂和还原剂的物质的量之比为1:1.
2.作为新世纪的年轻公民都应具有一定的化学科学素养,否则,在工作和生活中就可能闹笑话.下列有关媒体的报道与化学知识不相违背的是( )
| A. | 某饮料公司的广告语为“本公司生产的饮料不含任何化学物质” | |
| B. | 该科研人员发明了一种特殊催化剂,可以使水变为汽油 | |
| C. | 有关部门利用明矾对饮用水进行消毒杀菌,从而解决了灾民饮水难的问题 | |
| D. | 该科研机构发明了一种用植物秸秆生产乙醇的新工艺 |
12.一定量的稀H2SO4与过量铁粉反应时,为减缓反应速率,且不影响生成H2的总量,可向稀H2SO4中加入( )
| A. | NaOH固体 | B. | Na2SO4固体 | C. | NH4Cl饱和溶液 | D. | CH3COONa固体 |
16.含碘食盐中的碘是以碘酸钾(KIO3)形式存在的.已知在酸性溶液中IO3-和I-发生下列反应IO3-+5I-+6H+=3I2+3H2O.现有下列物质 ①稀硫酸;②pH试纸;③淀粉碘化钾溶液;④淀粉溶液.利用上述反应,可用来检验含碘食盐中含有IO3-的是( )
| A. | ①③ | B. | ②③ | C. | ①④ | D. | ②④ |
7.某温度下,可逆反应mA(g)+nB(g)??pC(g)的平衡常数为K,下列对K的说法正确的是( )
| A. | K值越大,表明该反应越有利于C的生成 | |
| B. | 若缩小反应器的容积,能使平衡正向移动,则K增大 | |
| C. | 温度越高,K一定越大 | |
| D. | 如果m+n=p,则K=1 |