题目内容
设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A、常温常压下,71g Cl2中含有的氯原子数目为NA |
| B、标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA |
| C、46 g 由NO2与N2O4组成的混合气体含有的原子数目为3NA |
| D、1 L 0.1 mol?L-1FeCl3溶液中含有的Fe3+离子数目为0.1NA |
考点:阿伏加德罗常数
专题:
分析:A、氯气的物质的量n=
,再根据氯气是双原子分子,求出含有的原子数;
B、氯气与水的反应是可逆反应;
C、根据NO2与N2O4的最简式均为NO2,求出混合气体中含有的NO2的物质的量,然后根据1molNO2含3mol原子构成来计算含有的原子数;
D、Fe3+是弱碱阳离子,在水溶液中会水解.
| m |
| M |
B、氯气与水的反应是可逆反应;
C、根据NO2与N2O4的最简式均为NO2,求出混合气体中含有的NO2的物质的量,然后根据1molNO2含3mol原子构成来计算含有的原子数;
D、Fe3+是弱碱阳离子,在水溶液中会水解.
解答:
解:A、氯气的物质的量n=
=
=1mol,而氯气是双原子分子,故1mol氯气含有2mol原子,个数为2NA,故A错误;
B、氯气与水的反应是可逆反应,不能进行彻底,故转移的电子数目小于0.1NA,故B错误;
C、NO2与N2O4的最简式均为NO2,故混合气体中含有的NO2的物质的量n=
=
=1mol,1molNO2含3mol原子,即3NA个,故C正确;
D、Fe3+是弱碱阳离子,在水溶液中会水解,故含有的Fe3+的个数小于0.1NA个,故D错误.
故选C.
| m |
| M |
| 71g |
| 71g/mol |
B、氯气与水的反应是可逆反应,不能进行彻底,故转移的电子数目小于0.1NA,故B错误;
C、NO2与N2O4的最简式均为NO2,故混合气体中含有的NO2的物质的量n=
| m |
| M |
| 46g |
| 46g/mol |
D、Fe3+是弱碱阳离子,在水溶液中会水解,故含有的Fe3+的个数小于0.1NA个,故D错误.
故选C.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
利用碳酸钠晶体(Na2CO3?10H2O)来配制0.5mol?L-1的碳酸钠溶液1 000mL,假如其他操作均是准确无误的,下列情况会引起配制溶液的浓度偏高的是( )
| A、称取碳酸钠晶体100 g |
| B、定容时俯视观察刻度线 |
| C、移液时,对用于溶解碳酸钠晶体的烧杯没有进行冲洗 |
| D、定容后,将容量瓶振荡均匀,静置发现液面低于刻度线,于是又加入少量水至刻度线 |
有关下列图象的说法正确的是( )
A、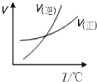 表示的反应速率随温度变化的关系可知该反应的△H>0 |
B、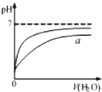 表示向pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,则其中曲线a对应的是醋酸 |
C、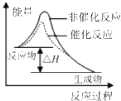 表示该反应为放热反应.且催化剂能降低反应的活化能、改变反应的焓变 |
D、 中开关K置于a或b处均可减缓铁的腐蚀 |
下列说法正确的是( )
A、已知1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化如图1,则NO2和CO反应的热化学方程式为:NO2(g)+CO(g)=CO2(g)+NO(g);△H=+234kJ/mol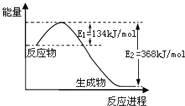 | ||||||||
B、一定温度下,利用pH计测定不同浓度醋酸溶液的pH值,得到如下数据:
| ||||||||
| C、已知CaCO3的Ksp=2.8×10-9,现将等体积的Na2CO3溶液与CaBr2溶液混合,若CaBr2溶液浓度为 5.6×10-5 mol/L,则生成沉淀所需Na2CO3溶液最小浓度为 5×10-5 mol/L | ||||||||
D、在不同条件下进行的异构化反应 X?Y 的进程图解如下.图2中的“ ”是X,“ ”是X,“ ”是Y,则可以计算得到乙的平衡常数K=1,且比甲的平衡常数要小 ”是Y,则可以计算得到乙的平衡常数K=1,且比甲的平衡常数要小 |
下列物质的沸点由高到低的排列正确的是( )
①丙烷②乙二醇③乙醇④丁烷⑤乙烷⑥2-甲基丙烷.
①丙烷②乙二醇③乙醇④丁烷⑤乙烷⑥2-甲基丙烷.
| A、②③⑥④①⑤ |
| B、②③④⑥①⑤ |
| C、④⑥①②③⑤ |
| D、④①③⑥②⑤ |
欲将蛋白质从水析出而又不改变它的性质,应加入( )
| A、酒精溶液 |
| B、Na2SO4溶液 |
| C、Pb(NO3)2溶液 |
| D、NaOH溶液 |
2013年4月24日,东航首次成功进行了由地沟油生产的生物航空燃油的验证飞行.能区别地沟油(加工过的餐饮废弃油)与矿物油(汽油、煤油、柴油等)的方法是( )
| A、加入水中,浮在水面上的是地沟油 |
| B、测定沸点,有固定沸点的是矿物油 |
| C、加入足量氢氧化钠溶液共热,不分层的是地沟油 |
| D、点燃,能燃烧的是矿物油 |
有100mL 3mol?LNaOH溶液和100mL 1mol?L-1 AlCl3溶液.按如下两种方法进行实验:①将氢氧化钠溶液分多次加到AlCl3溶液中;②将AlCl3溶液分多次加到NaOH溶液中.比较两次实验的结果是( )
| A、现象相同,沉淀量相等 |
| B、现象不同,沉淀量不等 |
| C、现象相同,沉淀量不等 |
| D、现象不同,沉淀量相等 |
下列说法正确的是( )
| A、强电解质一定易溶于水 |
| B、钢铁在海水中发生电化腐蚀时,铁是阳极被氧化 |
| C、对可逆反应,升高温度一定存在v(正)>v(逆) |
| D、相同浓度时,强酸中水的电离程度比弱酸的水的电离程度小 |