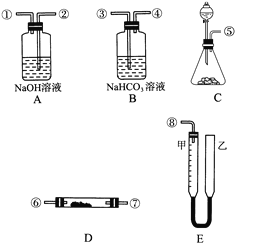
��Ŀ����
����Ŀ����ͼ����0.1000mol/L������ζ�ijδ֪Ũ�ȵ�NaOH��Һ��ʾ��ͼ��ij�εζ�ǰ�����ʢ������ζ�����Һ���λ�ã���ش� 
��1������A����������
��2����������������
�ζ�ǰ����ΪmL��
�ζ������ΪmL��
��3��ijʵ��С��ͬѧ������ʵ���ʵ���������±���ʾ�� ���ݱ������ݼ�����Ĵ���NaOH��Һ��ƽ��Ũ����mol/L����������λ��Ч���֣�
ʵ�� | ����NaOH��Һ�������mL�� | �ζ�ǰ����� | �ζ�������� |
1 | 20.00 | 1.20 | 23.22 |
2 | 20.00 | 2.21 | 24.21 |
3 | 20.00 | 1.50 | 23.48 |
��4�����÷�̪��ָʾ�����жϵ���ζ��յ��ʵ��������
��5�������м��ּٶ�����������ۣ������Ӱ�족����ƫ�ߡ�����ƫ�͡���
�����ζ�ǰ��ƿδ�ô���Һ��ϴ���Բⶨ�����Ӱ������
��ȡ����Һ�ĵζ��ܣ��ζ�ǰ�ζ��ܼ�������ݣ��ζ���������ʧ��
�۱�Һ����ʱ�����ζ�ǰ���ӣ��ζ����ӣ��Բⶨ�����Ӱ���� ��
���𰸡�
��1����ʽ�ζ���
��2��0.80��22.80
��3��0.1100
��4������Һ��ɫ�ɷۺ�ɫ��Ϊ��ɫ���Ұ�����ڲ���ɫ
��5����Ӱ�죻ƫ�ߣ�ƫ��
���������⣺��1���õζ��ܵ��¶��Dz�����������������������Ϊ��ʽ�ζ��ܣ�
���Դ��ǣ���ʽ�ζ��ܣ���2���ζ�ǰ���ζ����е�Һ�����Ϊ0.80mL���ζ��ζ����е�Һ�����Ϊ22.80mL��
���Դ��ǣ�0.80��22.80����3�����εζ����ĵ����Ϊ��22.02mL��22.00mL��21.98mL�����ݾ���Ч����ƽ������V��NaOH��=22.00mL��c�����⣩= ![]() =
=![]() =0.1100molL��1 ��
=0.1100molL��1 ��
���Դ��ǣ�0.1100����4���ζ�ʱ������Һ��ɫ�ɷۺ�ɫ��Ϊ��ɫ���Ұ�����ڲ���ɫ����˵���ﵽ�ζ��յ㣬
���Դ��ǣ�����Һ��ɫ�ɷۺ�ɫ��Ϊ��ɫ���Ұ�����ڲ���ɫ����5�������ζ�ǰ��ƿδ�ô���Һ��ϴ������Һ�����ʵ������䣬��Һ�����Ҳ���䣬����c�����⣩= ![]() �������ⶨ�����Ӱ�죻
�������ⶨ�����Ӱ�죻
��ȡ����Һ�ĵζ��ܣ��ζ�ǰ�ζ��ܼ�������ݣ��ζ���������ʧ�����±�Һ�����ƫ����c�����⣩= ![]() �������ⶨ���ƫ�ߣ�
�������ⶨ���ƫ�ߣ�
�۱�Һ����ʱ�����ζ�ǰ���ӣ��ζ����ӣ����±�Һ�����ƫС������c�����⣩= ![]() �������ⶨ���ƫ�ͣ�
�������ⶨ���ƫ�ͣ�
���Դ��ǣ���Ӱ�죻ƫ�ߣ�ƫ�ͣ�
�����㾫�������ڱ��⿼�������к͵ζ�����Ҫ�˽��к͵ζ�ʵ��ʱ��������ˮϴ���ĵζ������ñ�Һ��ϴ����װ��Һ�����ô���Һ��ϴ������ȡҺ�壻�ζ��ܶ���ʱ�ȵ�һ�����Ӻ��ٶ������۲���ƿ����Һ��ɫ�ĸı�ʱ���ȵȰ������ɫ�����Ϊ�ζ��յ���ܵó���ȷ�𰸣�

����Ŀ����2.0L�����ܱ������г���1.0mol PCl5 �� ���¶�ΪTʱ�������·�ӦPCl5��g��PCl3��g��+Cl2��g����H=+124kJmol��1 �� ��Ӧ�����вⶨ�IJ������ݼ��±���
ʱ��t/s | 0 | 50 | 150 | 250 | 350 |
n��PCl3��/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |
�ش��������⣺
��1����Ӧ��ǰ50s��ƽ������v��PCl5��= �� �÷�Ӧ�ġ�S0�����������������=������
��2���¶�ΪTʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��= ��
��3��������Ӧ����ƽ��״̬ʱ��PCl3���������Ϊ ��
Ҫ���ƽ��ʱPCl3������������ɲ�ȡ�Ĵ�ʩ�� ��
A���¶Ȳ��䣬ѹ�������������ѹǿ B��ʹ�ø�Ч����
C���¶Ⱥ�������䣬��СPCl5����ʼ�� D��������䣬��߷�Ӧ�¶�
��4�����¶�ΪTʱ������ʼʱ�������г���0.5mol PCl5��a mol Cl2ƽ��ʱPCl5��ת������Ϊ20%����a= ��
��5������ˮ�У����Ȼ�����ȫˮ�⣬�������ᣨH3PO4�����÷�Ӧ�Ļ�ѧ����ʽ�� ��