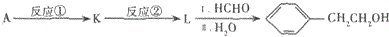题目内容
15.芳香酯I的合成路线如下:
已知以下信息:
①A-I均为芳香族化合物,B苯环上只有一个取代基,B能银镜反应,D的相对分子质量
比C大4,E的核磁共振氢谱有3组峰.
②

③

请回答下列问题:
(1)A→B的反应类型为氧化反应,D所含官能团的名称为羟基、羧基,E的名称为4-氯甲苯.
(2)E→F与F→G的顺序能否颠倒否(填“能”或“否”),理由如果颠倒,则(酚)羟基会被KMnO4/H+氧化.
(3)B与银氨溶液反应的化学方程式为
 .
.(4)I的结构简式为
 .
.(5)符合下列要求A的同分异构体还有13种.
①与Na反应并产生H2 ②芳香族化合物
(6)据已有知识并结合相关信息,写出以CH3CH2OH为原料制备CH3CH2CH2CH2OH的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.
 .
.
分析 A-I均为芳香族化合物,B的苯环上只有一个取代基,根据A的分子式可知A的侧链为饱和结构,A能够催化氧化生成B,B能够发生银镜反应,且能够发生信息③中反应,则B分子中侧链-CH2CHO结构,故B的结构简式为 ,A为
,A为 ,则C为
,则C为 ,D比C的相对分子质量大4,恰好为2分子氢气,则说明C与氢气发生加成反应生成D,故D为
,D比C的相对分子质量大4,恰好为2分子氢气,则说明C与氢气发生加成反应生成D,故D为 ;E的核磁共振氢谱有3组峰,E能够被酸性高锰酸钾溶液氧化,则E分子中含有甲基,且氯原子位于甲基的对位,故E为
;E的核磁共振氢谱有3组峰,E能够被酸性高锰酸钾溶液氧化,则E分子中含有甲基,且氯原子位于甲基的对位,故E为 ;E被酸性高锰酸钾溶液氧化成F,则F为
;E被酸性高锰酸钾溶液氧化成F,则F为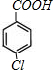 ;F在浓NaOH溶液中加热发生水解反应生成酚羟基,酚羟基、羧基与氢氧化钠发生中和反应,然后在酸性条件下转化成G,则G为
;F在浓NaOH溶液中加热发生水解反应生成酚羟基,酚羟基、羧基与氢氧化钠发生中和反应,然后在酸性条件下转化成G,则G为 ,G和D发生酯化反应生成I,则I为
,G和D发生酯化反应生成I,则I为 ,据此进行解答.
,据此进行解答.
解答 解:A-I均为芳香族化合物,B的苯环上只有一个取代基,根据A的分子式可知A的侧链为饱和结构,A能够催化氧化生成B,B能够发生银镜反应,且能够发生信息③中反应,则B分子中侧链-CH2CHO结构,故B的结构简式为 ,A为
,A为 ,则C为
,则C为 ,D比C的相对分子质量大4,恰好为2分子氢气,则说明C与氢气发生加成反应生成D,故D为
,D比C的相对分子质量大4,恰好为2分子氢气,则说明C与氢气发生加成反应生成D,故D为 ;E的核磁共振氢谱有3组峰,E能够被酸性高锰酸钾溶液氧化,则E分子中含有甲基,且氯原子位于甲基的对位,故E为
;E的核磁共振氢谱有3组峰,E能够被酸性高锰酸钾溶液氧化,则E分子中含有甲基,且氯原子位于甲基的对位,故E为 ;E被酸性高锰酸钾溶液氧化成F,则F为
;E被酸性高锰酸钾溶液氧化成F,则F为 ;F在浓NaOH溶液中加热发生水解反应生成酚羟基,酚羟基、羧基与氢氧化钠发生中和反应,然后在酸性条件下转化成G,则G为
;F在浓NaOH溶液中加热发生水解反应生成酚羟基,酚羟基、羧基与氢氧化钠发生中和反应,然后在酸性条件下转化成G,则G为 ,G和D发生酯化反应生成I,则I为
,G和D发生酯化反应生成I,则I为 .
.
(1)A→B为 催化氧化生成
催化氧化生成 ,该反应为氧化反应;G为
,该反应为氧化反应;G为 ,其分子中含有官能团为羟基、羧基,E为
,其分子中含有官能团为羟基、羧基,E为 ,名称为4-氯甲苯,
,名称为4-氯甲苯,
故答案为:氧化反应;羟基、羧基; 4-氯甲苯;
(2)E到G的反应中需要分别引进酚羟基和羧基,由于酚羟基容易被酸性高锰酸钾溶液氧化,所以E→F与F→G的顺序不能颠倒,
故答案为:否;如果颠倒,则(酚)羟基会被KMnO4/H+氧化;
(3)B分子中含有醛基,能够与与银氨溶液发生反应生成单质银,反应的化学方程式为: ,
,
故答案为: ;
;
(4)G和D发生酯化反应生成I,I的结构简式为: ,
,
故答案为: ;
;
(5)A为 ,其同分异构体符合:①与Na反应并产生H2,说明该有机物分子中含有羟基;②芳香族化合物,有机物分子中含有苯环,满足条件的有机物分子中可能含有的侧链为:①-CH(OH)CH3,②-OH、-CH2CH3,③1个-CH3,1个-CH2OH,④1个-OH、2个-CH3,其中①存在1种结构,②③都存在邻、间、对3种结构,④当3个取代基都在间位时存在1种结构,当3个取代基相邻时存在2种结构,当有2个取代基相邻时有3种结构,所以④总共有6种结构,
,其同分异构体符合:①与Na反应并产生H2,说明该有机物分子中含有羟基;②芳香族化合物,有机物分子中含有苯环,满足条件的有机物分子中可能含有的侧链为:①-CH(OH)CH3,②-OH、-CH2CH3,③1个-CH3,1个-CH2OH,④1个-OH、2个-CH3,其中①存在1种结构,②③都存在邻、间、对3种结构,④当3个取代基都在间位时存在1种结构,当3个取代基相邻时存在2种结构,当有2个取代基相邻时有3种结构,所以④总共有6种结构,
根据以上分析可知,满足条件的有机物总共有:1+3+3+6=13种,
故答案为:13;
(6)CH3CH2OH为原料制备CH3CH2CH2CH2OH,先将乙醇催化氧化生成乙醛,然后让乙醛发生信息反应③生成CH3CH=CHCHO,与氢气加成生成CH3CH2CH2CH2OH,所以合成流程为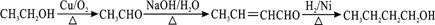 ,
,
故答案为: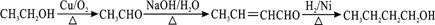 .
.
点评 本题考查有机物推断与合成,题目难度中等,综合分析确定B的结构简式,再结构反应条件进行推断,需要学生熟练掌握官能团的性质与转化.

 阅读快车系列答案
阅读快车系列答案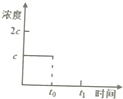 请你利用所学反应原理知识解决下列问题:
请你利用所学反应原理知识解决下列问题:Ⅰ.(1)已知:
①C(s)+2H2(g)═CH4(g)△H1=a kJ•mol-1;
②C(s)+$\frac{1}{2}$ O2(g)═CO(g)△H2=b kJ•mol-1;
则2CH4(g)+O2(g)═2CO(g)+4H2(g)△H=2(b-a)kJ•mmol-1(用含a、b的式子表示);
(2)碱性镁锰干电池是新开发的一种干电池,比普通锌锰干电池具有更加优越的性能,具有较大应用前景,其工作时总反应为:Mg+2MnO2+H2O═Mg(OH)2+Mn2O3;则工作时,正极发生还原反应(填反应类型),写出负极的电极反应式:Mg+2OH--2e-=Mg(OH)2;
(3)一定温度下,在1L的密闭容器放入足量草酸钙(固体所占体积忽略不计)发生反应:
CaC2O4(s)?CaO(s)+CO(g)+CO2(g),若前5min 内生成CaO的质量为11.2g,则该段时间内v(CaC2O4)=0.04mol•mim-1;
若某时刻达到平衡时c(CO2)=c;t0时刻,将容器体积缩小为原来的一半并固定不变,在t1时刻再次达到平衡,请在如图中画出t0以后此体系中CO2的浓度随时间变化的图象.
Ⅱ.与化学平衡类似,电离平衡的平衡常数,叫做电离常数(用K表示).如表是某温度下几种常见弱酸的电离平衡常数:
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.96×10-5 |
| HClO | HClO?ClO-+H+ | 3.0×10-8 |
| H2CO3 | H2CO3?H++HCO3- HCO3-?H++CO32- | K1=4.4×10-7 K2=5.6×10-11 |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++PO43- | K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
(4)根据以上条件,请比较同浓度的CH3COOHNa、NaClO、Na2CO3、NaHCO3、Na3PO4、NaH2PO4、Na2HPO4溶液,则它们pH最大的是Na3PO4(填化学式,下同),pH最小的是NaH2PO4.
(5)向NaClO溶液中通入过量的二氧化碳,发生的离子方程式为ClO-+CO2+H2O=HCO3-+HClO.
Ⅲ.(6)取一定量主要含有I-、Cl-等离子溶液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中$\frac{c({I}^{-})}{c(C{l}^{-})}$为4.7×10-7.【已知Ksp(AgCl)=1.8×10-10,Ksp(Agl)=8.5×10-17】.
 一定温度下可逆反应A(s)+2B(g)?2C(g)+D(g)△H<0.现将1molA和2molB加入甲容器中,将4molC和2molD加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图所示,隔板K不能移动).下列说法正确的是( )
一定温度下可逆反应A(s)+2B(g)?2C(g)+D(g)△H<0.现将1molA和2molB加入甲容器中,将4molC和2molD加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图所示,隔板K不能移动).下列说法正确的是( )| A. | 保持温度和活塞位置不变,在甲中再加入1mol A和2mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| B. | 保持温度和乙中的压强不变,分别向甲、乙中加入等质量的氦气后,甲中平衡不移动,乙中平衡向正反应方向移动 | |
| C. | 保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均减小 | |
| D. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 |
| A. |  锌锰干电池 | B. |  铅蓄电池 | C. |  氢燃料电池 | D. |  镍镉电池 |
| A. | v(B)=0.8mol/(L•s) | B. | v(A)=0.6mol/(L•s) | C. | v(C)=0.9mol/(L•s) | D. | v(B)=1.0mol/(L•s) |

| A. | 该物质可以使酸性KMnO4溶液褪色,也可发生消去反应 | |
| B. | 可以与NaHCO3溶液反应放出CO2气体 | |
| C. | 可以与FeCl3溶液反应显色,也可与Ag(NH3)2OH反应 | |
| D. | 该物质可与H2反应,1mol该物质最多消耗5mol H2反应 |

已知a、b、c均大于零.下列说法正确的是( )
| A. | H2、I2和HI分子中的化学键都是非极性共价键 | |
| B. | 断开2mol HI分子中的化学键所需能量约为(c+b+a)kJ | |
| C. | 相同条件下,1mol H2(g)和1mol I2(g)总能量小于2molHI(g)的总能量 | |
| D. | 向密闭容器中加入2mol H2(g)和2mol I2(g),充分反应后放出的热量小于2a kJ |
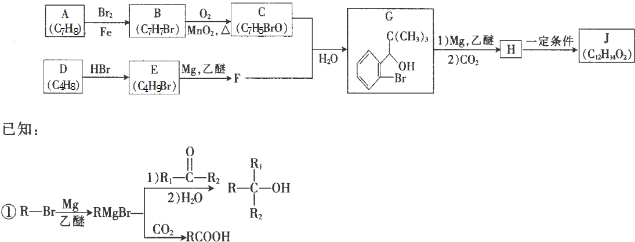
 .
.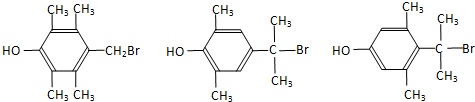 (写出一种即可).
(写出一种即可).