题目内容
在反应2K2Cr2O7+14HCl(浓)=2KCl+2CrCl3+3Cl2↑+7H2O反应中,氧化剂是 ,还原剂是 ,转移电子 ,反应中浓盐酸体现了 和 ,若转移3mol电子则在标准状况下生成气体的体积为 L.
考点:氧化还原反应
专题:氧化还原反应专题
分析:2K2Cr2O7+14HCl(浓)=2KCl+2CrCl3+3Cl2↑+7H2O中,Cr元素的化合价由+6价降低为+3价,Cl元素的化合价由-1价升高为0,该反应中转移6e-,以此来解答.
解答:
解:2K2Cr2O7+14HCl(浓)=2KCl+2CrCl3+3Cl2↑+7H2O中,Cr元素的化合价由+6价降低为+3价,则K2Cr2O7为氧化剂,Cl元素的化合价由-1价升高为0,则HCl为还原剂,该反应中转移6e-,生成KCl、CrCl3体现盐酸的酸性,生成Cl2体现盐酸的还原性,由反应可知转移6mol电子生成3mol气体,则转移3mol电子则在标准状况下生成气体的体积为1.5mol×22.4L/mol=33.6L,
故答案为:K2Cr2O7;HCl;6e-;酸性;还原性;33.6.
故答案为:K2Cr2O7;HCl;6e-;酸性;还原性;33.6.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,注意从化合价角度分析,侧重氧化还原反应中基本概念及转移电子的考查,题目难度不大.

练习册系列答案
相关题目
下列涉及有机物的说法正确的是( )
| A、乙烯、聚乙烯、苯乙烯都是不饱和烃,均可使酸性高锰酸钾褪色 |
| B、丙烷是一种清洁燃料,可用作燃料电池的燃料 |
| C、苯能与溴发生取代反应,因此不能用苯萃取溴水中的溴 |
| D、糖类、蛋白质、脂肪属于天然有机高分子化合物 |
NA表示阿伏加德罗常数的值,下列说法一定正确的是( )
| A、7.8g Na2S和Na2O2的混合物中含有的离子总数为0.3NA |
| B、将1mol KClO3和SO3的混合物溶于水,溶液中自由移动的离子数目为3NA |
| C、标准状况下,22.4L氯气与足量的铁反应,转移电子数为0.2 NA |
| D、常温常压下,将0.1mol氯气通入水中发生化学反应,转移电子数为0.1 NA |
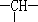 和一个-Cl,它可能的结构有
和一个-Cl,它可能的结构有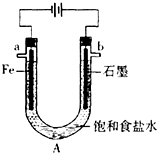 电解饱和食盐水装置的结构如图所示:
电解饱和食盐水装置的结构如图所示: