题目内容
14.在自来水蒸馏实验中,下列操作不正确的是( )| A. | 在蒸馏烧瓶中盛约$\frac{1}{3}$体积的自来水,并放入几粒沸石[KS5UKS5U] | |
| B. | 可以不用温度计 | |
| C. | 冷水从冷凝管上口入,下口出 | |
| D. | 取少量收集到的液体滴入硝酸银和稀硝酸,无明显现象 |
分析 A.蒸馏时蒸馏烧瓶中的液体体积占容积的$\frac{1}{3}$~$\frac{2}{3}$,还要加沸石防止暴沸;
B.在标准大气压下,水的沸点就是100℃,不需要温度计测量;
C.冷却水下口进、上口出可以达到更好的冷凝效果;
D.蒸馏水是纯水,不含氯离子.
解答 解:A.用蒸馏烧瓶加热液体时,液体的体积不超过容积的$\frac{2}{3}$,不少于$\frac{1}{3}$,并加入沸石,防止暴沸,故A正确;
B.制取蒸馏水时,水的沸点恒定,可以不用温度计,故B正确;
C.为了增强冷凝效果,下口进水,上口出水,故C错误;
D.蒸馏水是纯水,不含有杂质,因此加入硝酸酸化的硝酸银溶液,无明显现象,故D正确;
故选C.
点评 本题考查了自来水的蒸馏实验,涉及实验仪器的使用、离子检验等知识,题目难度不大,解题时注意蒸馏实验的原理,温度计的位置和冷凝水的流向.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.可用分液漏斗分离的一组混合物是( )
| A. | 硝基苯和酒精 | B. | 溴苯和溴 | C. | 甲苯和苯 | D. | 硝基苯和水 |
19.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,33.6L HF中含有氟原子的数目为1.5NA | |
| B. | 常温下,2.7g金属铝与足量浓度为18.4mol/L的浓H2SO4反应时转移的电子数为0.3NA | |
| C. | Na2O与Na2O2的混合物共1mol,阴离子数目为NA | |
| D. | CH4与P4的分子结构都是正四面体,每1mol CH4分子与P4分子都含有4NA个共价键 |
3.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 1L 0.1mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 4.6g Na在空气中完全反应生成Na2O、Na2O2,转移0.2 NA个电子 | |
| C. | 标准状况下,将22.4L Cl2通入水中发生反应,转移的电子数为NA | |
| D. | 100g 46%的乙醇溶液中,含H-O键的数目为NA |
4.分子式为C10H14且苯环上的一氯代物有两种的有机物有( )
| A. | 3种 | B. | 5种 | C. | 6种 | D. | 7种 |
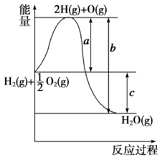 已知H2(g)+$\frac{1}{2}$O2(g)═H2O(g),反应过程中能量变化如图所示,则:
已知H2(g)+$\frac{1}{2}$O2(g)═H2O(g),反应过程中能量变化如图所示,则:
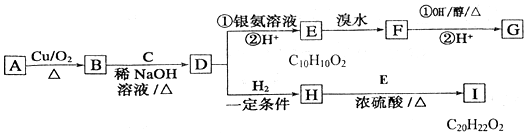
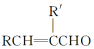 +H2O
+H2O ;E中含氧官能团的名称:羧基.
;E中含氧官能团的名称:羧基. +
+ $→_{加热}^{浓硫酸}$
$→_{加热}^{浓硫酸}$ +H2O.
+H2O.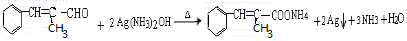 .
. .
.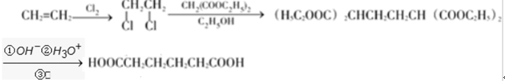 .
.