题目内容
20.硝酸是重要的氧化剂,铁、铜是生活中常见的金属.(1)Fe与Cu混合物与65%的硝酸反应会产生大量NO2,该反应使用的硝酸的物质的量浓度为14.44mol/L(已知ρ=1.4g/cm3).
(2)各为0.1mol的Cu与Fe混合物与足量的某浓度的硝酸反应产生4.48L气体(标准状况下),则该反应消耗的硝酸为0.7mol.
(3)4.4gFe与Cu混合物与过量的硝酸反应,放出的气体与标准状况下的1.12L的氧气混合后通入水中恰好被完全吸收,则其中铜的质量为1.6g.
(4)Fe与Cu混合物共有a mol,其中铜的物质的量分数为X,将该混合物全部投入b mol的硝酸中使其充分反应,假定硝酸的还原产物仅有NO,
①若溶液中金属离子只有Fe2+、Cu2+时,则b的取值范围是$\frac{8α(1-x)}{3}$<b≤$\frac{8α}{3}$(用a、x表示).
②若x=0.2时,溶液Fe2+与Fe3+的物质的量相等时,在标准状况下产生NO 6.72L,求a、b的值.(写出简要的计算过程)
分析 (1)依据溶液中溶质物质的量浓度和溶质质量分数的换算关系计算得到,c=$\frac{1000ml/L×ρg/c{m}^{3}×w%}{Mg/mol}$;
(2)铜和铁与足量硝酸反应发生氧化还原反应,硝酸被还原为氮氧化物,金属被氧化为硝酸盐,依据氮元素守恒计算元硝酸溶液的浓度;
(3)铜、铁与过量的硝酸反应生成硝酸铜、硝酸铁与氮的氧化物,氮的氧化物与氧气、水反应生成硝酸,纵观整个过程,金属提供的电子等于氧气获得的电子,根据二者质量与电子转移列方程计算.根据m=nM计算铜的质量;
(4)①当溶液中的金属离子只有Fe2+、Cu2+时,说明Cu恰好完全反应或者有剩余,而HNO3和Fe则完全反应(如果有硝酸剩余,则Fe2+则会被进一步氧化为Fe3+;如果有Fe剩余,则会和Cu2+继续反应),
HNO3→NO,N得3电子,设被还原的HNO3为y mol,总计得3y mol电子,
Cu→Cu2+,Cu失2电子,设参加反应的Cu为z mol,总计失2z mol电子,
Fe→Fe2+,Fe失2电子,参加反应的Fe为a(1-x) mol,总计失2a(1-x) mol电子,
根据得失电子总数相等,所以:3y=2z+2a(1-x) ①
反应中起酸作用的硝酸生成Fe(NO3)2和Cu(NO3)2,起氧化剂作用的硝酸生成NO,由N元素守恒,所以有:y+2a(1-x)+2z=b ②
联立方程,消去y,可得b的表达式(用a、x、z表示),参加反应的Cu的物质的量z的取值大于0,最大为ax,带入b的表达式计算.
②当x=0.2,溶液中Fe3+和Fe2+的物质的量相等时,Cu全部为铜离子,根据得失电子守恒和氮原子守恒计算.
解答 解:(1)Fe与Cu混合物与65%的硝酸反应会产生大量NO2,该反应使用的硝酸的物质的量浓度=$\frac{1000ml/L×1.4g/c{m}^{3}×65%}{63g/mol}$=14.44mol/L,
故答案为:14.44;
(2)各为0.1mol的Cu与Fe混合物与足量的某浓度的硝酸反应产生4.48L气体(标准状况下),物质的量n=$\frac{4.48L}{22.4L/mol}$=0.2mol,铜和铁与足量硝酸反应发生氧化还原反应,硝酸被还原为氮氧化物,金属被氧化为硝酸盐,Cu(NO3)2,Fe(NO3)3,氮元素守恒计算,则该反应消耗的硝酸物质的量=0.1mol×2+0.1mol×3+0.2mol=0.7mol,
故答案为:0.7;
(3)铜、铁与过量硝酸反应生成硝酸铜、硝酸银铁与氮的氧化物,氮的氧化物与氧气、水反应生成硝酸,纵观整个过程,金属提供的电子等于氧气获得的电子,
n(O2)=$\frac{1.12L}{22.4L/mol}$=0.05mol,
设Cu、Fe的物质的量分别为x、y,则:
根据质量列方程:x×64g/mol+y×56g/mol=4.4g
根据电子守恒列方程:2x+3×y=0.05mol×4
解得:x=0.025mol;y=0.05mol
m(Cu)=0.025mol×64g/mol=1.6g,
故答案为:1.6;
(4)①当溶液中的金属离子只有Fe2+、Cu2+时,说明Cu恰好完全反应或者有剩余,而HNO3和Fe则完全反应(如果有硝酸剩余,则Fe2+则会被进一步氧化为Fe3+;如果有Fe剩余,则会和Cu2+继续反应),
HNO3→NO,N得3电子,设被还原的HNO3为y mol,总计得3y mol电子,
Cu→Cu2+,Cu失2电子,设参加反应的Cu为z mol,总计失2z mol电子,
Fe→Fe2+,Fe失2电子,参加反应的Fe为a(1-x) mol,总计失2a(1-x) mol电子,
根据得失电子总数相等,所以:3y=2z+2a(1-x) ①
反应中起酸作用的硝酸生成Fe(NO3)2和Cu(NO3)2,起氧化剂作用的硝酸生成NO,由N元素守恒,所以有:y+2a(1-x)+2z=b ②
联立方程,消去y,整理得b=$\frac{4[2x+2α(1-x)]}{3}$③
参加反应的Cu的物质的量z的取值大于0,最大为ax,带入③中,可得$\frac{8α(1-x)}{3}$<b≤$\frac{8α}{3}$,
故答案为:$\frac{8α(1-x)}{3}$<b≤$\frac{8α}{3}$;
②当x=0.2,溶液中Fe3+和Fe2+的物质的量相等时,Cu全部为铜离子,所以参加反应的Cu为0.2amol,Fe3+和Fe2+的物质的量各为0.4amol,
HNO3→NO,N得3电子,产生6.72LNO气体即0.3mol,总计得0.9 mol电子,
Cu→Cu2+,Cu失2电子,则失0.4a mol电子,
Fe→Fe2+,Fe失2电子,则失0.8amol电子,
Fe→Fe3+,Fe失3电子,则失1.2amol电子,
根据得失电子总数相等,所以:0.9=0.4a+0.8a+1.2a,解得a=0.375mol,
根据氮原子守恒可知:b=2n(Cu2+)+2n(Fe2+)+3n(Fe3+)+n(NO)=2×0.2×0.375+2×0.4×0.375+3×0.4×0.375+0.3=1.2mol;
答:a的值为0.375,b的值为1.2;
点评 本题考查混合物计算、氧化还原反应的有关计算,铁、铜及硝酸的性质,因为铁是变价金属,和硝酸反应又涉及量不同产物不同,难度较大,根据始态终态法判断金属提供的电子等于氧气获得的电子是关键,注意氧化还原反应中守恒思想的运用.

| A | 2p能级电子半充满 |
| B | 与A同周期,且原子核外有2个未成对电子 |
| C | 基态原子核外有6个原子轨道排有电子,且只有1个未成对电子 |
| D | 其基态原子外围电子排布为msnmpn+2 |
| E | 前四周期元素中,E元素基态原子未成对电子数最多 |
| F | 基态F+各能级电子全充满 |
F元素在元素周期表中的位置为第四周期ⅠB族,F元素基态原子的外围电子排布图是
 .
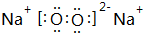
.(2)B和C可形成一种同时含有共价键和离子键的化合物,其电子式为
 .
.(3)A、B、C、D四种元素第一电离能由大到小的顺序为(用元素符号表示)N>O>S>NaB、C、D三种元素的简单离子的半径由大到小的顺序(用离子符号表示)为S2->O2->Na+.
(4)许多金属盐都可以发生焰色反应(如元素C),其原因是激发态的电子从能量较高的轨道跃迁到能量较低的轨道时,以一定波长(可见光区域)光的形式释放能量.
| A. | 热的纯碱溶液去污能力增强 | |
| B. | 配制FeCl3溶液,可加入少量的稀硫酸,以防止溶液浑浊 | |
| C. | 加热蒸干Al2(SO4)3溶液,最终能得到Al2(SO4)3晶体 | |
| D. | 利用明矾净水 |
| A. | 尽管NO2能与水反应生成硝酸,但 NO2不属于酸性氧化物 | |
| B. | Na2O 溶于水所得溶液能导电,据此可判断 Na2O属于电解质 | |
| C. | 氨气和氯化氢气体混合后生成的NH4Cl是离子化合物,因此该反应为离子反应 | |
| D. | 某气体只含N、H 两种元素,且质量之比为14:3,则该气体一定为纯净物 |
| A. | 赤铁矿的主要成分是Fe3O4 | |
| B. | 铁与水蒸气在高温下的反应产物为Fe2O3和H2 | |
| C. | 除去FeCl2溶液中的FeCl3杂质可以向溶液中加入铁粉,然后过滤 | |
| D. | Fe3+与KSCN产生红色沉淀,铁与水蒸气在高温下的反应产物为Fe3O4和H2 |
| A. |  硫磺颗粒 | B. |  浓硝酸 | C. |  硫酸钠溶液 | D. |  硝酸银溶液 |
 .
.