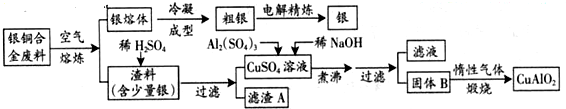
题目内容
19.某学生设计了如图实验方法分离NaCl和CaCl2两种固体混合物.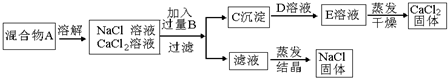
(1)B溶液是Na2CO3,加入过量B溶液的原因是使Ca2+沉淀完全,反应的离子方程式是Ca2++CO32-═CaCO3↓.
(2)经此实验方法分离得到的NaCl,经分析含有杂质,若要得到纯净的NaCl,还应补充的实验操作步骤是加入了过量的Na2CO3,滤液中加入足量盐酸:
(3)若要测定该混合物中NaCl和CaCl2的质量比,可称量干燥的C沉淀的质量(设为m1)和混合物A的质量(设为m2)来确定,混合物中NaCl和CaCl2的质量比为$\frac{{m}_{2}-1.11{m}_{1}}{1.11{m}_{1}}$(用m1、m2表示)
分析 分离NaCl和CaCl2两种固体混合物,溶解后加入过量B为碳酸钠溶液,生成沉淀C为碳酸钙沉淀和氯化钠溶液,碳酸钙和D为盐酸发生反应得到溶液E为氯化钙溶液,经蒸发可得到氯化钙固体;由于碳酸钠过量,所以滤液中的物质有氯化钠和碳酸钠,因此要得到纯净的氯化钠就需要除去碳酸钠,加入稀盐酸最合适,碳酸钠和稀盐酸生成氯化钠和水和二氧化碳,蒸发后最后的固体物质是氯化钠,据此答题.
解答 解:分离NaCl和CaCl2两种固体混合物,溶解后加入过量B为碳酸钠溶液,生成沉淀C为碳酸钙沉淀和氯化钠溶液,碳酸钙和D为盐酸发生反应得到溶液E为氯化钙溶液,经蒸发可得到氯化钙固体;由于碳酸钠过量,所以滤液中的物质有氯化钠和碳酸钠,因此要得到纯净的氯化钠就需要除去碳酸钠,加入稀盐酸最合适,碳酸钠和稀盐酸生成氯化钠和水和二氧化碳,蒸发后最后的固体物质是氯化钠,
(1)根据上面的分析可知,B溶液是Na2CO3,加入过量Na2CO3溶液的原因是 使Ca2+沉淀完全,反应的离子方程式是 Ca2++CO32-═CaCO3↓,
故答案为:Na2CO3;使Ca2+沉淀完全;Ca2++CO32-═CaCO3↓;
(2)根据上面的分析,若要得到纯净的NaCl,还应补充的实验操作步骤是加入了过量的Na2CO3,滤液中加入足量盐酸,
故答案为:加入了过量的Na2CO3,滤液中加入足量盐酸;
(3)C沉淀为碳酸钙,其质量m1,则混合物中CaCl2的质量为$\frac{{m}_{1}}{100}×111$,混合物的质量为m2,则混合物中NaCl的质量为m2-$\frac{{m}_{1}}{100}×111$,所以混合物中NaCl和CaCl2的质量比为(m2-$\frac{{m}_{1}}{100}×111$):$\frac{{m}_{1}}{100}×111$=$\frac{{m}_{2}-1.11{m}_{1}}{1.11{m}_{1}}$,
故答案为:$\frac{{m}_{2}-1.11{m}_{1}}{1.11{m}_{1}}$.
点评 本题考查物质的分离、提纯知识,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握实验的原理和操作方法,为解答该题的关键,难度不大.

| A. | NaCl中含有杂质Na2SO4(适量氯化钡) | |
| B. | FeSO4 中含有杂质CuSO4(铁粉) | |
| C. | SO2中含有少量HCl气体(氢氧化钠溶液) | |
| D. | CO2中含有少量的CO(灼热的氧化铜) |
限选试剂:浓硫酸、1.0mol•L-1HNO3、1.0mol•L-1盐酸、1.0mol•L-1NaOH、3% H2O2、0.1mol•L-1 KI、0.1mol•L-1 CuSO4、20% KSCN、澄清石灰水、氧化铜、蒸馏水.
(1)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3.验证固体产物中钾元素存在的方法是利用焰色反应,现象是透过蓝色钴玻璃,观察到紫色的火焰.
(2)固体产物中铁元素存在形式的探究.
①提出合理假设
假设1:全部是铁单质;
假设2:全部为FeO;
假设3:同时存在铁单质和FeO.
②设计实验方案证明你的假设
③实验过程
根据②中方案进行实验.在答题卡上按下表的格式写出实验步骤、预期现象与结论.
| 实验步骤 | 预期现象与结论 |
| 步骤1: | 部分固体不溶解 |
| 步骤2: | |
| 步骤3:继续步骤2中的(2),进行固液分离,用蒸馏水洗涤固体至洗涤液无色.取少量固体于试管中,滴加过量HCl后,静置,取上层清液,滴加适量H2O2,充分振荡后滴加KSCN. |
| A. | 加入较多NaHSO4的溶液中:Fe3+、Cl-、NO3-、Na+ | |
| B. | 通入大量CO2气体的溶液中:Na+、Ba2+、Cl-、NO3- | |
| C. | 通入大量NH3的溶液中:Ca2+、Na+、HCO3-、Cl- | |
| D. | 通入大量SO2气体的溶液中:Na+、SO32-、NH4+、SO42- |
| A | B | |
| C | D |
a.吸收99.7kJ b.吸收29.7kJ c.放出20.6kJ d.放出241.8kJ
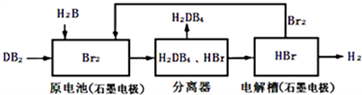
(2)DB2通过下列工艺流程可制化工业原料H2DB4和清洁能源H2.
①查得:
| 化学键 | H-H | Br-Br | H-Br |
| 键能(kJ/mol) | 436 | 194 | 362 |
②根据资料:
| 化学式 | Ag2SO4 | AgBr |
| 溶解度(g) | 0.796 | 8.4×10-6 |
③在原电池中,负极发生的反应式为SO2+2H2O-2e-=4H++SO42-.
④在电解过程中,电解槽阴极附近溶液pH变大(填“变大”、“变小”或“不变”).
⑤将该工艺流程用总反应的化学方程式表示为:SO2+2H2O=H2+H2SO4.该生产工艺的优点有Br2被循环利用或能源循环供给或获得清洁能源(答一点即可).
(3)溴及其化合物广泛应用于医药、农药、纤维、塑料阻燃剂等,回答下列问题:海水提溴过程中,向浓缩的海水中通入Cl2,将其中的Br-氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,其离子方程式为3 Br2+6 CO32-+3H2O=5 Br-+BrO3-+6HCO3-(或3 Br2+3CO32-=5 Br-+BrO3-+3CO2↑).