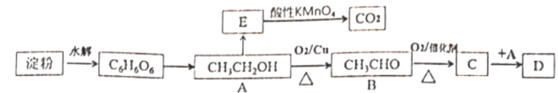
题目内容
【题目】海水是巨大的资源宝库,从海水中提取食盐和单质溴的工艺流程如图。
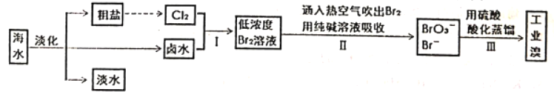
(1)海水淡化的常用方法有_____(请写出一种)
(2)由海水提取的粗盐中含有Ca2+、Mg2+、SO![]() 等离子,为了除去这些离子,需要依次加入稍过量的NaOH、BaCl2、_____(填化学式),过滤之后,再加入适量盐酸。
等离子,为了除去这些离子,需要依次加入稍过量的NaOH、BaCl2、_____(填化学式),过滤之后,再加入适量盐酸。
(3)步骤1中获得Br2的离子方程式________
步骤I和步骤II操作的最终目的是_________
(4)配平步骤II操作对应的化学方程式:___Br2+___Na2CO3=__NaBrO3+__ NaBr+___CO2
(5)步骤Ⅲ中用H2SO4酸化处理重新得到Br2,写出该反应的离子方程式_____
若有48g溴单质生成,转移电子的物质的量为____mol
【答案】蒸馏法(或电渗析法或离子交换膜法) Na2CO3 Cl2+2Br-=2C1-+Br2 富集溴元素(或提高溴元素的浓度) 3 3 1 5 3 5Br-+BrO![]() +6H+=3Br2+3H2O 0.5
+6H+=3Br2+3H2O 0.5
【解析】
根据工艺流程图分析可知,通过海水蒸发得到淡水、NaCl、卤水,向卤水中通入电解NaCl产生的氯气,发生反应Cl2+2Br-=2Cl-+Br2,利用热空气吹出溴,用纯碱溶液吸收Br2,发生反应3Br2+3Na2CO3=NaBrO3+5NaBr+3CO2,将溶液酸化蒸馏得到工业溴,据此分析解答问题。
(1)海水淡化常用的方法有蒸馏法、电渗析法、离子交换膜法等;
(2)由海水提取的粗盐中含有Ca2+、Mg2+、SO![]() 等离子,为了除去这些离子,需要依次加入稍过量的NaOH、BaCl2、Na2CO3,Na2CO3不仅除去Ca2+,还可以除去过量的BaCl2溶液;
等离子,为了除去这些离子,需要依次加入稍过量的NaOH、BaCl2、Na2CO3,Na2CO3不仅除去Ca2+,还可以除去过量的BaCl2溶液;
(3)步骤Ⅰ中Cl2将Br-氧化为Br2,反应的离子方程式为Cl2+2Br-=2Cl-+Br2,因海水中溴元素含量较少,步骤I中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,目的在于富集溴元素(或提高溴元素的浓度);
(4)反应中,Br2中Br元素的化合价分别由0价升高至+5价,由0价降低至-1价,根据得失电子守恒配平方程式有3Br2+3Na2CO3=NaBrO3+5NaBr+3CO2;
(5)步骤Ⅲ中用H2SO4酸化处理,发生归中反应重新得到Br2,反应的离子方程式为5Br-+BrO![]() +6H+=3Br2+3H2O,反应中每生成3molBr2转移5mol电子,48g溴单质的物质的量为0.3mol,因此,若有48g溴单质生成,转移电子的物质的量为0.5mol。
+6H+=3Br2+3H2O,反应中每生成3molBr2转移5mol电子,48g溴单质的物质的量为0.3mol,因此,若有48g溴单质生成,转移电子的物质的量为0.5mol。