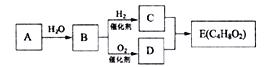
题目内容
【题目】Fe2O3俗称氧化铁红,常用作油漆等着色剂。某实验小组用部分氧化的FeSO4为原料,以萃取剂X(甲基异丁基甲酮)萃取法制取高纯氧化铁并进行铁含量的测定。实验过程中的主要操作步骤如图1。

已知:①在较高的盐酸浓度下,Fe3+能溶解于甲基异丁基甲酮,当盐酸浓度降低时,该化合物解离;
②3DDTCNH4+Fe3+===(DDTC)3Fe↓+3NH4+。
请回答下列问题:
(1)用萃取剂X萃取的步骤中,以下关于萃取分液操作的叙述中,正确的是______________。

A.FeSO4原料中含有的Ca2+、Cu2+等杂质离子几乎都在水相中
B.为提高萃取率和产品产量,实验时分多次萃取并合并萃取液
C.溶液中加入X,转移至分液漏斗中,塞上玻璃塞,如图2用力振摇
D.振摇几次后需打开分液漏斗上口的玻璃塞放气
(2)下列试剂中,可作反萃取的萃取剂Y最佳选择是________。
A.高纯水 B.盐酸 C.稀硫酸 D.酒精
(3)吸油量是反映氧化铁红表面性质的重要指标。吸油量大,说明氧化铁红表面积较大,则用在油漆中会造成油漆假稠,影响质量。不同浓度的两种碱溶液对产物吸油量影响如图3所示,则上述实验过程中选用的碱溶液为_______________(填“NaOH”或“NH3·H2O”),反应的化学方程式为__________。

(4)操作A的步骤包括___________________________________________。
(5)现准确称取4.000 g样品,经酸溶、还原为Fe2+,在容量瓶中配成100 mL溶液,用移液管移取25.00 mL溶液于锥形瓶中,用0.100 0 mol/L的K2Cr2O7溶液进行滴定(还原产物是Cr3+),消耗K2Cr2O7溶液20.80 mL。
①用移液管从容量瓶中吸取25.00 mL溶液后,把溶液转移到锥形瓶中的具体操作为______________
②产品中铁的含量为___________(假设杂质不与K2Cr2O7反应)。
【答案】AB A NaOH (DDTC)3Fe+3NaOH===3DDTCNa+Fe(OH)3↓ 过滤、洗涤、灼烧 将移液管垂直放入稍倾斜的锥形瓶中,使管尖与锥形瓶内壁接触,松开食指使溶液全部流出,数秒后,取出移液管 69.89%
【解析】
部分氧化的硫酸亚铁,加入盐酸溶解,加入过氧化氢氧化亚铁离子为铁离子,在较高的盐酸浓度下,Fe3+能溶解于甲基异丁基甲酮,以萃取剂X(甲基异丁基甲酮)萃取法制取弃去水相,加入萃取剂Y分液弃去有机相,得到含铁离子的溶液,加入DDTC-NH4 ,发生反应3DDTC-NH4+Fe3+=(DDTC)3-Fe↓+3NH4+,过滤得到沉淀加入氢氧化钠溶液得到氢氧化铁沉淀,蒸发灼烧得到高纯氧化铁,具此分析作答。
(1)A.FeSO4原料溶于盐酸,加入过氧化氢氧化亚铁离子变为铁离子,在较高浓度的盐酸中,Fe3+能溶解于甲基异丁基甲酮,所以溶液中含有的Ca2+、Cu2+等杂质离子几乎都在水相中,所以A选项是正确的;
B.实验时分多次萃取并合并萃取液,可以提高萃取率和产品产量,所以B选项是正确的;
C.溶液中加入X,转移至分液漏斗中,塞上玻璃塞,萃取分液时,加入萃取剂后,应使液体混合均匀,两手分别顶住玻璃活塞,使分液漏斗倒转过来,不能用力振摇,故C错误;
D.振摇几次后漏斗倒置,打开旋塞放气,不需打开分液漏斗上口的玻璃塞放气,故D错误;
故答案为AB。
(2)根据元素守恒可以知道,萃取后水相中铁的存在形式是FeCl3,用甲基异丁基甲酮萃取时,在有机相中铁元素以HFeCl4形式存在,因为加高纯水时,酸度[或c(H+)]降低,HCl(浓)+FeCl3![]() HFeCl4平衡向转化为FeCl3的方向移动,所以用高纯水可以进行反萃取;
HFeCl4平衡向转化为FeCl3的方向移动,所以用高纯水可以进行反萃取;
(3)根据图3两条曲线可以知道:用NaOH溶液,获得的氧化铁表面积小,吸油量低,选用的碱溶液为NaOH,反应的化学方程式为(DDTC)3Fe+3NaOH===3DDTCNa+Fe(OH)3↓;
(4)操作A为过滤、洗涤、灼烧得到固体氧化铁;
(5)①用移液管从容量瓶中吸取25.00 mL溶液后,把溶液转移到锥形瓶中的具体操作为将移液管垂直放入稍倾斜的锥形瓶中,使管尖与锥形瓶内壁接触,松开食指使溶液全部流出,数秒后取出移液管;
②在容量瓶中配成100 mL溶液,用移液管移取25.00 mL溶液于锥形瓶中,用0.1000 mol/L的K2Cr2O7溶液进行滴定(还原产物是Cr3+),消耗K2Cr2O7溶液20.80 mL,滴定过程中发生反应6Fe2++Cr2O72-+14H+===2Cr3++6Fe3++7H2O,由方程式可知存在数量关系:6Fe2+~Cr2O72-,则n(Fe2+)=0.1 mol/L×0.02080 L×![]() ×6=0.04992 mol,铁元素守恒计算产品中铁的含量
×6=0.04992 mol,铁元素守恒计算产品中铁的含量![]() ×100%=69.89%。
×100%=69.89%。