题目内容
9.燃料电池将是21世纪获得电能的重要途径.近几年开发的丁烷燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过.其工作原理的示意图如下:
请回答下列问题:
(1)Pt(b)电极是电池的正极,电极反应式为O2+4e-+4H+═2H2O;
Pt(a)电极发生氧化反应(填“氧化”或“还原”),电极反应式为CH4-8e-+2H2O═CO2+8H+.
(2)若电解质溶液改为KOH溶液,Pt(b)电极的电极反应式为O2+2H2O+4e-═4OH-;Pt(a)电极的电极反应式为C4H10+34OH--26e-═4CO32-+22H2O.
(3)如果该电池工作时电路中通过1.2mol电子,则消耗掉O2在标准状况下的体积为6.72L.
分析 (1)该原电池中质子交换膜只允许质子和水分子通过,说明电解质溶液为酸性溶液,燃料电池中,通入燃料的电极为负极,负极上失电子发生氧化反应,通入氧化剂的电极为正极,正极上得电子发生还原反应;
(2)若电解质溶液改为KOH溶液,正极的电极反应式为:O2+2H2O+4e-═4OH-;负极的电极反应式为:C4H10+34OH--26e-═4CO32-+22H2O;
(3)根据O2~~4mole-,进行计算.
解答 解:(1)该原电池中质子交换膜只允许质子和水分子通过,说明电解质溶液为酸性溶液,燃料电池中,通入燃料的电极为负极,负极上甲烷失电子和水反应生成二氧化碳和氢离子,电极反应式为:CH4-8e-+2H2O=8H++CO2,通入氧化剂的电极为正极,正极上氧气得电子和氢离子反应生成水而发生还原反应,
电极反应式为2O2+8e-+8H+=4H2O,
故答案为:正,O2+4e-+4H+═2H2O;氧化,CH4-8e-+2H2O═CO2+8H+;
(2)若电解质溶液改为KOH溶液,正极的电极反应式为:O2+2H2O+4e-═4OH-;负极的电极反应式为:C4H10+34OH--26e-═4CO32-+22H2O,故答案为:O2+2H2O+4e-═4OH-;C4H10+34OH--26e-═4CO32-+22H2O;
(3)O2~~4mole-,
22.4L 4mol
V 1.2mol
所以V=$\frac{1.2×22.4}{4}$=6.72L,故答案为:6.72L.
点评 本题考查原电池原理,侧重考查电极反应式书写,结合电解质溶液书写电极反应式,注意:氧负离子碱性条件下不是结合氢离子,题目难度中等.

练习册系列答案
相关题目
20.下列各组中的两个反应所属反应类型相同的是( )
| A. | 光照甲烷和氯气的混合气体,混合气体颜色变浅;乙烯能使溴水褪色 | |
| B. | 乙炔在氧气中燃烧;乙烯能使酸性高锰酸钾溶液褪色 | |
| C. | 工业上由乙烯和水反应生成乙醇;由苯与液溴反应生成溴苯 | |
| D. | 由乙烯制取聚乙烯;由苯制取硝基苯 |
14.关于氨的下列叙述中,错误的是( )
| A. | 分别蘸有浓氨水和浓盐酸的两根玻璃棒靠近时有白烟生成 | |
| B. | 氨气极易溶解于水,因此可用来做喷泉实验 | |
| C. | 氯化铵受热分解有氨气生成,因此实验室可以用加热氯化铵的方法制备氨气 | |
| D. | 氨具有还原性,可以被氧化成NO |
18.下列变化需克服相同类型作用力的是( )
| A. | 碘和干冰的升华 | B. | 硅和C60的熔化 | ||
| C. | 氯化氢和氯化钾的溶解 | D. | 水和氯化钠的电解 |
19. “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC下列叙述中正确的是( )
 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC下列叙述中正确的是( )| A. | 分子中所有的原子共面 | B. | 1molEGC与4molNaOH恰好完全反应 | ||
| C. | 易发生水解反应和取代反应 | D. | 遇FeCl3溶液发生显色反应 |
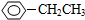 、HCOOH、CH3COOC2H5.
、HCOOH、CH3COOC2H5.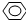 -OH ②CH2=CH2③CH≡CH ④
-OH ②CH2=CH2③CH≡CH ④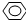 -CH2OH ⑤
-CH2OH ⑤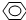 -CH3 ⑥CH3COO-
-CH3 ⑥CH3COO- ⑦CH3CH2CH2CH2Br
⑦CH3CH2CH2CH2Br