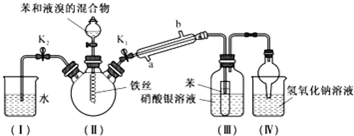
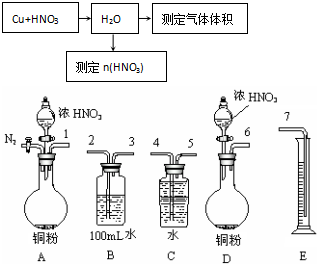
题目内容
2.常温下某透明溶液中由水电离出的c(H+)=l×l0-12mol/L,则一定大量共存的离子组是( )| A. | K+、Fe2+、SO42-、NO3- | B. | Al3+、Na+、HCO-3、Cl- | ||
| C. | Fe3+、K+、Cl-、SCN- | D. | K+、SO2-4,Na+、NO-3 |
分析 由水电离出的c(H+)=10-12mol/L,溶液为酸或碱溶液,根据离子不能结合生成水、气体、沉淀等,则离子能大量共存,以此来解答.
解答 解:由水电离出的c(H+)=10-12mol/L,溶液为酸或碱溶液,
A.碱性条件下Fe2+不能大量共存,酸性条件下Fe2+、NO3-发生氧化还原反应而不能大量共存,故A错误;
B.HCO-3能与酸反应又能与碱反应,则一定不能大量存在,故B错误;
C.Fe3+、SCN-发生络合反应而不能大量共存,故C错误;
D.论酸或碱溶液中该组离子之间不反应,则能够共存,故D正确.
故选D.
点评 本题考查离子的共存,为高频考点,侧重于学生的分析能力的考查,明确习题中的信息及离子的反应是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
12.对于可逆反应2M(g)+N(g)?2Q(g)在一定条件下达到化学反应限度时,下列有关说法正确的是( )
| A. | 消耗2molM 的同时生成2mol Q | |
| B. | 反应混合物中Q的物质的量不再改变 | |
| C. | M与Q体积相等 | |
| D. | M、N、Q的物质的量之比为2:1:2 |
13.设NA为阿伏伽德罗常数的值,下列有关说法不正确的是( )
| A. | 1molOH-离子中含电子数目为10NA | |
| B. | 0.5L 0.2mol•L-1的NaCl溶液中含有的Na+数是0.1NA | |
| C. | 分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量约为28 g | |
| D. | 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
17.同温同压下,等质量的SO2和CO2,正确的叙述是( )
| A. | 分子数之比1:1 | B. | 密度之比4:11 | C. | 密度之比11:16 | D. | 体积之比11:16 |
7.(CN)2、(SCN)2、(OCN)2称“类卤素”,与卤素单质的性质相似,而其阴离子性质也相似,如:2Fe+3(SCN)2═2Fe(SCN)3,2Fe+3Cl2═2FeCl3.以此判断下列化学方程式中错误的是( )
| A. | (CN)2+H2O?HCN+HCNO | |
| B. | (SCN)2+2Cu$\frac{\underline{\;\;△\;\;}}{\;}$ 2CuSCN | |
| C. | (OCN)2+2NaOH═NaOCN+NaOCNO+H2O | |
| D. | MnO2+4HSCN(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ (SCN)2↑+Mn(SCN)2+2H2O |
11.次氯酸的电子式为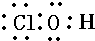 ,则1mol该物质所含有的电子的物质的量是( )
,则1mol该物质所含有的电子的物质的量是( )
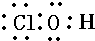 ,则1mol该物质所含有的电子的物质的量是( )
,则1mol该物质所含有的电子的物质的量是( )| A. | 14mol | B. | 15mol | C. | 26mol | D. | 27mol |
10.下列物质中存在顺反异构体的是( )
| A. | 2-氯丙烯 | B. | 1,2-二氯乙烯 | C. | 2-甲基-2-丁烯 | D. | 1-丁烯 |