题目内容
水质检验中,测定水的硬度时,用到氨-氯化氨(NH3-NH4Cl)缓冲溶液,控制溶液在pH=10左右.则关于该缓冲溶液的说法不正确的是( )
| A、将缓冲溶液加水稀释时,pH一定会减小 |
| B、将缓冲溶液升温,pH一定没有变化 |
| C、在缓冲溶液中,水的电离受到抑制 |
| D、在缓冲溶液中,一定有c(NH+4)>c(Cl-) |
考点:弱电解质在水溶液中的电离平衡,盐类水解的应用
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:A、碱性溶液稀释,碱性减弱;
B、升高温度,会影响水解平衡的移动;
C、溶液pH=10,说明溶液中离子的水解程度大于弱电解质的电离程度;
D、根据溶液中的电荷守恒来回答判断.
B、升高温度,会影响水解平衡的移动;
C、溶液pH=10,说明溶液中离子的水解程度大于弱电解质的电离程度;
D、根据溶液中的电荷守恒来回答判断.
解答:
解:A、该溶液是碱性,稀释后碱性减弱,pH一定会减小,故A正确;
B、升高温度,溶液中的电离平衡、水解平衡都会受到影响,pH一定会变化,故B错误;
C、在缓冲溶液中,存在氨水的电离平衡和铵根离子的水解平衡,因为显示碱性,氨水的电离程度大于铵根离子的水解程度,氨水的电离对水的电离起到抑制作用,所以水的电离受到抑制,故C正确;
D、溶液中的电荷守恒c(NH+4)+c(H+)=c(OH-)+c(Cl-),溶液显示碱性,所以c(H+)<c(OH-),则有c(NH+4)>c(Cl-),故D正确.
故选B.
B、升高温度,溶液中的电离平衡、水解平衡都会受到影响,pH一定会变化,故B错误;
C、在缓冲溶液中,存在氨水的电离平衡和铵根离子的水解平衡,因为显示碱性,氨水的电离程度大于铵根离子的水解程度,氨水的电离对水的电离起到抑制作用,所以水的电离受到抑制,故C正确;
D、溶液中的电荷守恒c(NH+4)+c(H+)=c(OH-)+c(Cl-),溶液显示碱性,所以c(H+)<c(OH-),则有c(NH+4)>c(Cl-),故D正确.
故选B.
点评:本题以缓冲溶液为考点涉及盐的水解原理、弱电解质的电离等知识,注意知识的归纳和整理是关键,难度中等.

练习册系列答案
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
下列化学式代表的物质一定有固定沸点的是( )
| A、C3H6 |
| B、C2H4O2 |
| C、CF2Cl2 |
| D、C3H7OH |
对比饱和链烃、不饱和链烃的结构和性质,苯的独特性质具体来说是( )
| A、难氧化,易加成,难取代 |
| B、易取代,能加成,难氧化 |
| C、易氧化,易加成,难取代 |
| D、因是单双键交替结构,故易加成为环己烷 |
下列有关说法中,不正确的是( )
| A、焰火的五彩缤纷是某些金属元素的性质的展现 |
| B、SiO2可用于制造光导纤维,其性质稳定,不溶于强酸、强碱 |
| C、“光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化合物有关 |
| D、蒙古牧民喜欢用银器盛放鲜牛奶有其科学道理:用银器盛放鲜牛奶,溶入的极微量的银离子,可杀死牛奶中的细菌,防止牛奶变质 |
下列说法中,正确的是( )
| A、物 质的化学反应与体系的能量变化不是同时发生的 |
| B、化学键可以使离子相结合,不可以使原子相结合 |
| C、在相同的温度和压强下,等体积的O2和O3含有相同数目的原子 |
| D、金属元素和非金属元素分界线附近的元素多用于制造半导体 |
钠与铯都是碱金属元素,下列关于铯及其化合物的叙述中不正确的是( )
| A、其单质在常温下与H2O的反应比Na更剧烈 |
| B、其单质能从NaCl水溶液中置换出Na |
| C、CsOH属于强碱,其碱性强于NaOH |
| D、其单质极易被氧化,可保存在煤油中 |

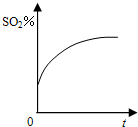
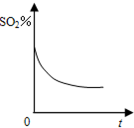
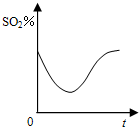
 设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )
设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )