题目内容
短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中;常温下,Z的单质能溶于W的最高价氧化物对应水化物的稀溶液,却不溶于其浓溶液.下列说法正确的是( )
| A、通过电解熔融的Z、Q形成的化合物可制取Z单质 |
| B、原子半径的大小顺序为W>Q>Z>X>Y |
| C、元素Y的最高正化合价为+6 |
| D、XQ3分子中,中心原子是sp3杂化 |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中,联想NH3极易溶于水,可知X为氮元素,Y为氧元素;
常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液,说明Z为铝元素,W为硫元素,因为铝在常温下能溶于稀硫酸,在浓硫酸中发生钝化;Q只能为Cl元素,据此进行解答.
常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液,说明Z为铝元素,W为硫元素,因为铝在常温下能溶于稀硫酸,在浓硫酸中发生钝化;Q只能为Cl元素,据此进行解答.
解答:
解:短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中,联想NH3极易溶于水,可知X为氮元素,Y为氧元素;常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液,说明Z为Al元素,W为硫元素,因为铝在常温下能溶于稀硫酸,在浓硫酸中发生钝化;Q只能为氯元素,
A.Z为Al元素、Q为Cl元素,二者形成的化合物为氯化铝,氯化铝为共价化合物,熔融氯化铝不导电,无法电解氯化铝获得金属铝,一般需要通过电解熔融氧化铝获得金属铝,故A错误;
B.同周期自左而右原子半径逐渐减小,电子层越多原子半径越大,故原子半径大小为:Z(Al)>W(S)>Q(Cl)>X(N)>Y(O),故B错误;
C.Y为O元素,氧元素不存在正价,则不会显示+6价,故C错误;
D.X为N元素、Q为Cl元素,XQ3分子为NCl3,该化合物的中心原子N原子形成了3个σ 键,且存在1个孤对电子,其杂质轨道数为4,所以中心原子采用sp3杂化,故D正确;
故选D.
A.Z为Al元素、Q为Cl元素,二者形成的化合物为氯化铝,氯化铝为共价化合物,熔融氯化铝不导电,无法电解氯化铝获得金属铝,一般需要通过电解熔融氧化铝获得金属铝,故A错误;
B.同周期自左而右原子半径逐渐减小,电子层越多原子半径越大,故原子半径大小为:Z(Al)>W(S)>Q(Cl)>X(N)>Y(O),故B错误;
C.Y为O元素,氧元素不存在正价,则不会显示+6价,故C错误;
D.X为N元素、Q为Cl元素,XQ3分子为NCl3,该化合物的中心原子N原子形成了3个σ 键,且存在1个孤对电子,其杂质轨道数为4,所以中心原子采用sp3杂化,故D正确;
故选D.
点评:本题考查元素周期律、结构位置性质关系,题目难度中等,试题侧重基础知识的考查,正确推断元素名称是解题关键,需要学生熟练掌握常见元素化合物性质、元素周期表结构、元素周期律内容.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
能正确表示下列反应的离子方程式是( )
| A、向碳酸氢钙溶液中滴入过量澄清石灰水:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O | ||||
B、NH4HSO3溶液与足量的NaOH溶液混合加热:NH4++HSO3-+2OH-
| ||||
| C、向NaHSO4溶液中逐滴加入Ba(OH)2溶液至溶液呈中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | ||||
| D、向KIO3与KI混合溶液中加入醋酸发生反应生成I2:IO3-+5I-+6H+═3I2+3H2O |
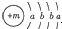 ,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.
,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.



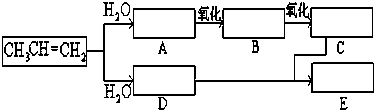
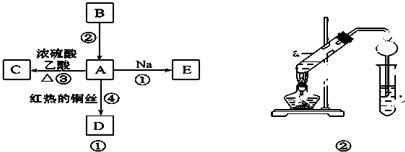
 )对花香和果香的香韵具有提升作用,故常用于化妆品和食品工业.乙酸苯甲酯的合成路线如图:
)对花香和果香的香韵具有提升作用,故常用于化妆品和食品工业.乙酸苯甲酯的合成路线如图:
 )互为同系物的是
)互为同系物的是 B.
B. C.
C. D.
D.
 C.2CH3CHO+H2
C.2CH3CHO+H2