题目内容
1.120℃、101kPa时,由两种烃组成的混合气体0.5L在4.5L O2中完全燃烧,测得反应后气体总体积小于5L,其中含CO2 0.8L,则生成水蒸气的体积为( )| A. | 0.7L | B. | 1.0L | C. | 1.6L | D. | 2.5L |
分析 先根据烃的燃烧通式及反应后气体体积减小确定混合烃中平均氢原子数,再根据0.5L混合烃生成了0.8L二氧化碳计算出混合烃中平均碳原子数,根据计算结果可知一定含有甲烷,再根据平均氢原子数得出一定为甲烷和乙炔的混合物,然后根据混合烃的平均碳原子数计算出二者的体积之比,最后根据燃烧的关系式及氢原子守恒CH4~2H2O、C2H2~H2O计算出生成水蒸气的体积.
解答 解:设该混合烃平均化学式为CxHy,则:
CxHy+(x+$\frac{y}{4}$)O2=xCO2+$\frac{y}{2}$H2O
150℃时水为气体,要使反应后体积小于5L,则有该反应各气体物质的系数关系为:
1+x+$\frac{y}{4}$>x+$\frac{y}{2}$,
解得:y<4,
0.5L混合烃产生0.8LCO2,相同条件下气体的物质的量之比等于其体积之比,
则0.5mol混合烃污染燃烧生成0.8mol二氧化碳,1mol混合烃完全燃烧生成1.6mol二氧化碳,则x=1.6;由此可知混合烃中必有甲烷CH4,另一种烃氢数一定小于4,氢原子数小于4的烃只有乙炔,
设含有xmol甲烷、ymol乙炔,
根据碳原子守恒看得:$\frac{xmol×1+ymol×2}{xmol+ymol}$=1.6,
解得:x:y=2:3,即:甲烷与乙炔物质的量之比为2:3,
相同条件下体积之比就等于物质的量之比,则混合气体中甲烷的体积为:0.5L×$\frac{2}{2+3}$=0.2L,乙炔的体积为:0.5L×$\frac{2}{2+3}$=0.3L,
根据氢原子守恒可得关系式:CH4~2H2O、C2H2~H2O,
1 2 1 1
0.2L 0.4L 0.3L 0.3L
则生成水的体积为:0.4L+0.3L=0.7L,
故选A.
点评 本题考查了混合烃燃烧的计算,题目难度中等,注意掌握烃的燃烧通式,能够根据反应前后气体体积不会判断混合烃中氢原子数的范围,经过对混合烃的平均分子式的讨论得出混合物为甲烷和乙炔为解答本题的关键.

 中考解读考点精练系列答案
中考解读考点精练系列答案| A. | 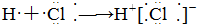 | B. |  | ||
| C. |  | D. |  |
| A. | 10℃,20ml,3mol/L的X溶液 | B. | 20℃,10ml,5mol/L的X溶液 | ||
| C. | 20℃,30ml,2mol/L的X溶液 | D. | 10℃,10ml,2mol/L的X溶液 |
| A. | 2 min内,v(H2O2)=2 mol.L-1•min-l | |
| B. | MnOp是催化剂,能加快H2 O2的分解速率 | |
| C. | 升高温度或增大H2 O2的浓度,均能加快H2O2的分解速率 | |
| D. | 若将5 mol•L-1 H2O2溶液的体积增至6 mL,则H2O2的分解速率增至原来的2倍 |
| A. | CuSO4 | B. | SiO2 | C. | NH4Cl | D. | Al |
| A. | 碱土金属元素是 IA 族元素 | B. | 被称为“生命元素”的是15号元素P | ||
| C. | 稀有气体元素都是非金属元素 | D. | 氕、氘、氚均可用做制造氢弹的原料 |
 某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示.则稀溶液中Fe(NO3)3、HNO3、Cu(NO3)2物质的量浓度之比为( )(已知氧化性顺序:HNO3>Fe(NO3)3>Cu(NO3)2)
某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示.则稀溶液中Fe(NO3)3、HNO3、Cu(NO3)2物质的量浓度之比为( )(已知氧化性顺序:HNO3>Fe(NO3)3>Cu(NO3)2)