题目内容
7.将质量为1.15g钠用刺了孔的铝箔包裹后放入水中,反应结束后共收集到0.055mol气体.请回答下列问题:(1)1.15g钠与水反应,理论上生成气体的体积(标准状况)为0.56L.
(2)Al和NaOH溶液反应也能生成H2,写出该反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑,该反应的氧化剂是H2O.
(3)若反应后溶液的体积为50mL,求溶液中NaOH的物质的量浓度?(要求写出计算过程)
分析 (1)发生反应:2Na+2H2O=2NaOH+H2↑,根据方程式中对比关系计算生成氢气体积;
(2)发生反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,反应本质是Al与水反应生成氢氧化铝与氢气,氢氧化铝又与氢氧化钠反应生成偏铝酸钠与水,反应中水是氧化剂;
(3)氢气的总体积减去钠与水反应生成氢气的体积就是铝与氢氧化钠反应生成的氢气体积,根据方程式恒计算NaAlO2物质的量、Al反应消耗NaOH物质的量,进而计算溶液中NaOH的物质的量浓度.
解答 解:(1)设生成氢气的体积为V,则:
2Na+2H2O=2NaOH+H2↑
46g 22.4L
1.15g V
V=$\frac{22.4L×1.15g}{46g}$=0.56L
故答案为:0.56L;
(2)发生反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,反应离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,反应本质是Al与水反应生成氢氧化铝与氢气,氢氧化铝又与氢氧化钠反应生成偏铝酸钠与水,反应中水是氧化剂,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;H2O;
(3)1.15g Na的物质的量为$\frac{1.15g}{23g/mol}$=0.05mol,
Na反应生成氢气物质的量为$\frac{0.56L}{22.4L/mol}$=0.025mol,
则Al反应生成氢气为0.055mol-0.025mol=0.03mol,
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2mol 2mol 3mol
0.02 0.02mol 0.03mol
所以剩余氢氧化钠0.05mol-0.02mo=0.03mol,故氢氧化钠的物质的量浓度=$\frac{0.03mol}{0.05L}$=0.6mol/L;
答:混合溶液中NaOH的物质的量浓度为0.6mol/L.
点评 本题考查混合物有关计算,注意氢气来源于钠与水反应及铝和氢氧化钠反应,题目难度中等.

| A. | K+、Ba2+、NO3-、CO32- | B. | Cu2+、K+、NO3-、SO42- | ||
| C. | Na+、K+、Cl-、SO42- | D. | Fe2+、H+、Cl-、NO3- |
| A. | 等质量的N2和CO所含分子数均为NA | |
| B. | 一定温度下,1 L 1 mol•L-1的CH3COONa溶液含NA个CH3COO- | |
| C. | 1 mol SO2与足量O2在一定条件下反应生成SO3,共转移2NA个电子 | |
| D. | 在标准状况下,22.4 L CH4与18 g H2O所含的电子数均为10NA |
| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 铜粉与稀硝酸的反应:Cu+2H+═Cu2++H2↑ | |
| C. | 氢氧化铜与稀盐酸反应:OH-+H+═H2O | |
| D. | 碳酸钠溶液与足量稀硫酸的反应:CO32-+2H+═H2O+CO2↑ |
| A. | X、Y、Z的分子个数比为3:1:2 | |
| B. | X的生成速率与Z的生成速率相等 | |
| C. | 混合气体的密度不再改变 | |
| D. | 单位时间内生成3n mol X,同时消耗n mol Y |
| A. | 将苯与浓硝酸、浓硫酸的混合物在100℃水浴加热条件下反应可生成硝基苯 | |
| B. | 用酸性高锰酸钾溶液即可检验CH2═CH-CHO中的碳碳双键 | |
| C. | 将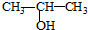 与NaOH的醇溶液共热制备CH3-CH═CH2 与NaOH的醇溶液共热制备CH3-CH═CH2 | |
| D. | 利用核磁共振氢谱,可以鉴别CH3OCH3和CH3CH2OH |
| 序号 | 甲 | 乙 | 丙 |
| ① | CO2 | NO2 | Ca(OH)2 |
| ② | HCl | CO2 | Ca(OH)2 |
| ③ | NO2 | NH3 | MgCl2 |
| ④ | NO2 | O2 | BaCl2 |
| ⑤ | CO2 | NH3 | CaCl2 |
| A. | ①②③ | B. | ①④⑤ | C. | ①②③⑤ | D. | 全部 |
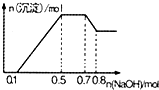 某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、Cl-中的几种,若向溶液中加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入的物质的量之间的关系如图所示,下列说法正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、Cl-中的几种,若向溶液中加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入的物质的量之间的关系如图所示,下列说法正确的是( )| A. | 溶液中的阳离子只有H+、Mg2+、Al3+ | |
| B. | 无法确定溶液中是否含有CO32-、SO42-和Cl- | |
| C. | 溶液中n(NH4+)=0.2mol | |
| D. | n(H+):n(Al3+):n(Mg2+)=1:1:1 |
