题目内容
(1)1.56g显+1价的某金属与足量盐酸完全反应,生成0.04g氢气,则该金属的摩尔质量为 .
(2)将标准状况下V升HCl气体溶于100g水中,所得溶液的密度为dg/ml,则溶液中HCl的物质的量的浓度为 .
(2)将标准状况下V升HCl气体溶于100g水中,所得溶液的密度为dg/ml,则溶液中HCl的物质的量的浓度为
考点:摩尔质量,物质的量浓度
专题:计算题
分析:(1)令金属的摩尔质量为M,根据n=
计算金属、氢气的物质的量,根据电子转移守恒列方程计算;
(2)根据n=
计算气体的物质的量,根据m=nM计算气体的质量,根据V=
计算溶液的体积,再根据c=
计算.
| m |
| M |
(2)根据n=
| V |
| Vm |
| m |
| ρ |
| n |
| V |
解答:
解:(1)令金属的摩尔质量为M,根据电子转移守恒,则:
×1=
×2,解得M=39g/mol,故答案为:39g/mol;
(2)解:标准状况下,将V L气体的物质的量=
=
mol,其质量=
mol×36.5g/mol=
g,溶剂质量100g,故溶液的体积=
=
L,故所得溶液的物质的量浓度=
=
mol/L,故答案为:
mol/L.
| 1.56g |
| M |
| 0.04g |
| 2g/mol |
(2)解:标准状况下,将V L气体的物质的量=
| VL |
| 22.4L/mol |
| V |
| 22.4 |
| V |
| 22.4 |
| 36.5V |
| 22.4 |
100g+
| ||
| 1000ρg/L |
| 2240+36.5V |
| 22400ρ |
| ||
|
| 1000ρV |
| 2240+36.5V |
| 1000ρV |
| 2240+36.5V |
点评:本题考查物质的量有关计算,比较基础,注意利用电子转移守恒计算,气体溶于水得到溶液质量需要用密度换算溶液体积时解题关键,注意密度单位的换算,题目较简单.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案
相关题目
工业酒精中常含有甲醇,甲醇有剧毒,不能食用,其分子结构可能如图所示的模型表示.下列有关甲醇的叙述中,错误的是( )
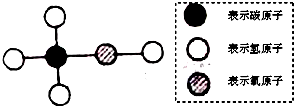

| A、甲醇的化学式为CH4O |
| B、甲醇的相对分子质量为32 |
| C、甲醇中C、H、O三种元素的质量比为1:4:1 |
| D、甲醇中氧元素的质量分数为50% |
设nA为阿伏加德罗常数的值,下列说法正确的是(相对原子质量:C-l2 H-1)( )
| A、2.24L NO2含有0.2nA个氧原子 |
| B、常温常压下,C2H4和C3H6组成的28g混合气体中含4NA个氢原子 |
| C、1 molC2H6分子中含有7NA个极性键 |
| D、常温下pH=13的NaOH溶液中含有的0.1 NA个OH- |
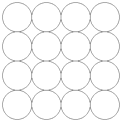 某同学在学习等径球最密堆积(立方最密堆积A1和六方最密堆积A3)后,提出了另一种最密堆积形式Ax.如图所示为Ax堆积的片层形式,然后第二层就堆积在第一层的空隙上.请根据Ax的堆积形式回答:(简要写出过程)
某同学在学习等径球最密堆积(立方最密堆积A1和六方最密堆积A3)后,提出了另一种最密堆积形式Ax.如图所示为Ax堆积的片层形式,然后第二层就堆积在第一层的空隙上.请根据Ax的堆积形式回答:(简要写出过程)