题目内容
已知氧化还原反应(1)2Fe3++2I-═2Fe2++I2,(2)2Fe2++Br2═2Fe3++2Br-,(3)2Br-+Cl2═Br2+2Cl-.现向含amolFeI2和bmolFeBr2的混合溶液中逐渐通入cmolCl2.反应随Cl2的通入明显地分成几个阶段进行.试分别填写在c值增大过程中不同c值范围内被氧化的离子及被氧化离子的物质的量(用含a、b、c的代数式表示)
则:① ② ③ ④ ⑤ ⑥ .
| 反应物物质的量之间的关系 | 此阶段被氧化的离子的符号 | 被氧化离子的物质的量 | ||||
| 0<c≤a | ① | ② | ||||
a<c≤
| ③ | ④ | ||||
| ⑤ | ⑥ |
考点:氧化性、还原性强弱的比较,氧化还原反应的计算
专题:氧化还原反应专题
分析:含amolFeI2和bmolFeBr2的混合溶液中含有I-的物质的量为2amol,Fe2+的物质的量为(a+b)mol,Br-的物质的量为2bmol.由2Fe3++2I-═2Fe2++I2,Fe2++Br2═2Fe3++2Br-,2Br-+Cl2═Br2+2Cl-,知离子还原性I->Fe2+>Br-,当向其中逐渐通入氯气时,溶液中的I-、Fe2+、Br-依次被氧化.
解答:
解:含amolFeI2和bmolFeBr2的混合溶液中含有I-的物质的量为2amol,Fe2+的物质的量为(a+b)mol,Br-的物质的量为2bmol.由2Fe3++2I-═2Fe2++I2,Fe2++Br2═2Fe3++2Br-,2Br-+Cl2═Br2+2Cl-,知离子还原性I->Fe2+>Br-,当向其中逐渐通入氯气时,溶液中的I-、Fe2+、Br-依次被氧化.
根据Cl2+2I-═2Cl-+I2,若I-恰好被完全氧化,则消耗氯气的物质的量等于I-的物质的量的一半,即c=a,此时被氧化的I-的物质的量为2cmol;
根据Cl2 +2Fe2+═2Cl-+2Fe3+,若Fe2+恰好被完全氧化(此时I-已被完全氧化),则消耗氯气的物质的量为氧化I-、Fe2+的总和,即c=a+
=
,此时被氧化的Fe2+的物质的量为2(c-a)mol;
根据 Cl2 +2Br-═2Cl-+Br2,若Br-恰好被完全氧化(此时I-、Fe2+已被完全氧化),则消耗氯气的物质的量为氧化I-、Fe2+、Br-的总和,即c=
+b=
,此时被氧化的Br-的物质的量为2×(c-
)=(2c-3a-b)mol.
故答案为:①I-②2cmol ③Fe2+④2(c-a)mol ⑤Br-⑥(2c-3a-b)mol.
根据Cl2+2I-═2Cl-+I2,若I-恰好被完全氧化,则消耗氯气的物质的量等于I-的物质的量的一半,即c=a,此时被氧化的I-的物质的量为2cmol;
根据Cl2 +2Fe2+═2Cl-+2Fe3+,若Fe2+恰好被完全氧化(此时I-已被完全氧化),则消耗氯气的物质的量为氧化I-、Fe2+的总和,即c=a+
| a+b |
| 2 |
| 3a+b |
| 2 |
根据 Cl2 +2Br-═2Cl-+Br2,若Br-恰好被完全氧化(此时I-、Fe2+已被完全氧化),则消耗氯气的物质的量为氧化I-、Fe2+、Br-的总和,即c=
| 3a+b |
| 2 |
| 3(a+b) |
| 2 |
| 3a+b |
| 2 |
故答案为:①I-②2cmol ③Fe2+④2(c-a)mol ⑤Br-⑥(2c-3a-b)mol.
点评:本题考查了离子还原性强弱的比较以及氧化还原反应的有关计算,难度中等,注意离子还原性大小关系I->Fe2+>Br-.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
下列电离方程式中,正确的是( )
| A、NH3?H2O═NH4++OH- |
| B、CuCl2═Cu2++Cl- |
| C、H2CO3═2H++CO32- |
| D、NaOH═Na++OH- |
下列说法不正确的是( )
| A、二氯乙烷存在二种同分异构体 |
| B、油脂在酸性条件下的水解产物都能与金属钠反应 |
| C、除去乙酸乙酯中少量的乙酸,用饱和碳酸钠溶液洗涤后分液 |
| D、等物质的量的甲烷与氯气混合气,在光照条件下生成的产物物质的量也相等 |
下列叙述正确的是( )
| A、1mol/LCH3COOH与1mol/L CH3COONa溶液等体积混合,溶液中CH3COOH和CH3COO-的总数为2NA |
| B、将1molNH4NO3溶于一定浓度的稀氨水中,溶液呈中性,若不考虑挥发,溶液中一定含有NA个NH4+ |
| C、AgCl悬浊液中存在平衡:AgCl(s)?Ag+(aq)+Cl-(aq),往其中加入少量 NaCl粉末,平衡会向左移动,溶液中离子的总浓度会减小 |
| D、常温下,0.01mol?L-1醋酸溶液与等体积0.02 mol?L-1NaNO3溶液混合后有:2c (NO3-)═c (CH3COO-)+c (CH3COOH) |
下列说法错误的是( )
| A、对废旧金属的最好处理方法是回收、再用 |
| B、提炼金属要经过矿石的富集、冶炼、精炼三步 |
| C、活泼金属的冶炼都是通过电解其盐溶液 |
| D、热还原法中还原剂有焦炭、一氧化碳、氢气或活泼金属等 |
下列有机反应方程式书写正确的是( )
A、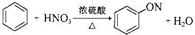 | |||
| B、H2C=CH2+Br2→CH3CHBr2 | |||
C、CH3COOH+CH3CH2OH
| |||
D、CH4+2O2
|