题目内容
16.根据原子结构、元素周期表和元素周期律的知识回答下列问题:(1)A元素次外层电子数是最外层电子数的1/4,外围电子的电子排布图是
 .
.(2)B是1~36号元素原子核外未成对电子数最多的元素,B元素的名称是铬,该元素在元素周期表中的位置是第四周期第ⅥB族.
(3)C元素基态原子的电子排布图是如图1中的②(填序号),另一电子排布图不能作为基态原子的电子排布图是因为它不符合C(填编号“A”、“B”、“C”).
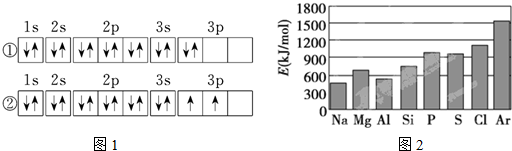
A.能量最低原理 B.泡利原理 C.洪特规则
(4)第三周期元素的气态电中性基态原子失去最外层一个电子转化为气态基态正离子所需的最低能量叫做第一电离能(设为E).如图2所示:
①同周期内,随着原子序数的增大,E值变化的总趋势是增大;
②根据图中提供的信息,试推断E氧<E氟(填“>”、“<”或“=”,下同);
③根据第一电离能的含义和元素周期律,试推断E镁>E钙.
分析 (1)次外层电子数是最外层电子数$\frac{1}{4}$的元素只能是氖;
(2)1~36号元素,未成对电子数最多的元素外围电子排布为3d54s1,共有6个未成对电子;
(3)由电子排布图中的电子数知,C元素是硅,根据洪特规则,当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,且自旋方向相同;
(4)由图可知,同周期内,随着原子序数的增大,E值变化的总趋势是增大,但原子处于半满、全满是,能量较低,第一电离能高于同周期相邻元素;同主族金属性越强,第一电离能越小.
解答 解:(1)次外层电子数是最外层电子数$\frac{1}{4}$的元素只能是氖,外围电子的电子排布图是 ,故答案为:
,故答案为: ;
;
(2)1~36号元素,未成对电子数最多的元素外围电子排布为3d54s1,共有6个未成对电子,该元素是铬,处于周期表中第四周期第ⅥB族,
故答案为:铬;第四周期第ⅥB族;
(3)由电子排布图中的电子数知,C元素是硅,根据洪特规则,当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,且自旋方向相同,故硅元素基态原子的电子排布图为②,即另一电子排布图不能作为基态原子的电子排布图是因为它不符合C,
故答案为:②;C;
(4)①由图可知,同周期内,随着原子序数的增大,E值变化的总趋势是增大,故答案为:增大;
②由图可知,同周期内,随着原子序数的增大,E值变化的总趋势是增大,但原子处于半满、全满是,能量较低,第一电离能高于同周期相邻元素,故E氧<E氟,
故答案为:<;
③同主族金属性越强,第一电离能越小则E镁>E钙,故答案为:>.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构推断元素、电子排布规律、第一电离能变化规律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案| A. | 油脂的水解反应都是皂化反应 | |
| B. | 淀粉水解和纤维素水解得到的最终产物不同 | |
| C. | 蛋白质水解的最终产物均为葡萄糖 | |
| D. | 油脂的水解可得到甘油 |
| A. | 将氢氧化铁溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 澄清石灰水与少量小苏打溶液混合:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- | |
| C. | 碳酸钙溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 向CuSO4溶液中加入Na2O2:2 Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑ |
| A. | HI | B. | NaCl | C. | Br2 | D. | MgF2 |
 .
. 的系统命名为3-甲基-戊烷.
的系统命名为3-甲基-戊烷. .
. 中,共平面的碳原子最多有13个,共直线的原子最多有5个,该分子中有4种不同化学环境的H原子.
中,共平面的碳原子最多有13个,共直线的原子最多有5个,该分子中有4种不同化学环境的H原子. ;
; 有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验: .
.