题目内容
9.某温度下重水中存在电离平衡D2O?D++OD-,D2O的离子积常数=1.0×10-12,若pD=-lgc(D+),该温度下有关分析不正确的是( )| A. | 0.1molNaOD溶于重水制成1L溶液,pD=13 | |
| B. | 将pD=4的DCl的重水溶液稀释100倍,所得溶液pD不等于6 | |
| C. | 向30mL0.5mol•L-1NaOD的重水溶液中加入20mL0.5mol•L-1DCl的重水溶液,所得溶液pD=11 | |
| D. | pD=10的NaOD的重水溶液中,由重水电离出的c(OD-)为1×10-10mol•L-1 |
分析 D2O的离子积常数=1.0×10-12,结合水的离子积常数分析,pD=6为中性,联系酸碱混合计算解答.
解答 解:D2O的离子积常数=1.0×10-12,结合水的离子积常数分析,pD=6为中性.
A、溶液中c(OD-)=0.1mol/L,则c(D+)=1.0×10-11,pD=11,故A错误;
B、pD=4的DCl的重水溶液中c(D+)=1.0×10-4,稀释10倍后c(D+)=1.0×10-5,pH=5,故B正确;
C、混合溶液中c(OD-)=$\frac{0.03L×0.5mol/L-0.02L×0.5mol/L}{0.05L}$=0.1mol/L,则c(D+)=1.0×10-11,pD=11,故C正确;
D、NaOD溶液中的D+全部有水电离出来,pD=10,说明水电离出的c(D+)=1.0×10-10,而水电离出来的氢离子和氢氧根离子浓度相等,故此溶液中水电离出的c(OD-)=1.0×10-10mol/L,故D正确;
故选A.
点评 本题结合重水的电离考查了水的离子积常数,注意温度影响其大小,题目难度中等.

练习册系列答案
相关题目
20.下列实验中,操作和现象均正确且能实验相应目的是( )
| 选项 | 实验目的 | 操作 | 现象 |
| A | 比较酸性:HF>H2CO3 | 向盛有少量NaHCO3溶液的试管中滴加足量HF溶液 | 有无色气体产生 |
| B | 验证SO2的漂白性 | 将SO2通入石蕊溶液中 | 石蕊溶液褪色 |
| C | 比较非金属性:Br>I | 将溴水滴加到KI-淀粉溶液中 | 溶液变蓝 |
| D | 检验某溶液中是否含有SO42- | 向盛有少量待测液的试管中先滴加Ba(NO3)2溶液,再滴加稀盐酸 | 有白色沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
17.某有机化合物M的结构简式为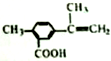 ,有关该化合物的叙述正确的是( )
,有关该化合物的叙述正确的是( )
 ,有关该化合物的叙述正确的是( )
,有关该化合物的叙述正确的是( )| A. | 该有机物属于芳香烃 | |
| B. | 仅考虑取代基在苯环上的位置变化,M的同分异构体有9种 | |
| C. | 该有机物的碳原子一定处于同一平面 | |
| D. | 该有机物一定条件下只能发生加成反应和酯化反应 |
4.根据下表给出的几种物质的熔点、沸点数据,判断下列有关说法中错误的是( )
| 晶体 | NaCl | KCl | AlCl3 | SiCl4 | 单质B |
| 熔点/℃ | 810 | 776 | 190 | -68 | 2300 |
| 沸点/℃ | 1465 | 1418 | 180 | 57 | 2500 |
| A. | SiCl4是分子晶体 | B. | 单质B可能是原子晶体 | ||
| C. | AlCl3加热能升华 | D. | NaCl中化学键的强度比KCl中的小 |
18.在锌与某浓度的盐酸反应的实验中,实验员得到下面的结果:
(1)写出实验中发生反应的离子方程式:Zn+2H+=Zn2++H2↑,
(2)仔细观察A~F的实验数据对比,你可以得到关于温度影响反应速率结论,用此结论,计算:55℃时,2g 锌薄片溶解于酸中需花12.5 s.
(3)对比结果B与F,解释结果F那么快的原因:B中锌是块状,F中锌是粉末状,粉末状时锌与酸溶液的接触面要 比块状时的接触面大得多.
| 锌的质量(g) | 锌的形状 | 温度(℃) | 溶解于酸花的时间(s) | |
| A | 2 | 薄片 | 5 | 400 |
| B | 2 | 薄片 | 15 | 200 |
| C | 2 | 薄片 | 25 | 100 |
| D | 2 | 薄片 | 35 | 50 |
| E | 2 | 薄片 | 45 | 25 |
| F | 2 | 粉末 | 15 | 5 |
(2)仔细观察A~F的实验数据对比,你可以得到关于温度影响反应速率结论,用此结论,计算:55℃时,2g 锌薄片溶解于酸中需花12.5 s.
(3)对比结果B与F,解释结果F那么快的原因:B中锌是块状,F中锌是粉末状,粉末状时锌与酸溶液的接触面要 比块状时的接触面大得多.
 某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol•L-1的硫酸溶液中,图为反应产生氢气速率与反应时间的关系图.
某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol•L-1的硫酸溶液中,图为反应产生氢气速率与反应时间的关系图.
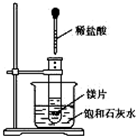 如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管中开始放入几小块镁片,再滴入5mL稀盐酸,试完成下列问题.
如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管中开始放入几小块镁片,再滴入5mL稀盐酸,试完成下列问题. 、
、 、
、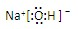 、
、 .
.