题目内容
2.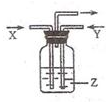 下列各组物质中.气体X和气体Y在通常条件下同时通入盛有溶液z的洗气瓶中(如图所示),一定没有沉淀生成的是( )
下列各组物质中.气体X和气体Y在通常条件下同时通入盛有溶液z的洗气瓶中(如图所示),一定没有沉淀生成的是( )| X | Y | Z | |
| A | NO2 | SO2 | BaCl2 |
| B | NH3 | O2 | Al2(SO4)3 |
| C | NH3 | CO2 | NaCl(饱和) |
| D | CO | O2 | Ca(OH)2 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.二氧化氮溶于水生成硝酸,根据硝酸和二氧化硫的性质分析生成的物质,根据二氧化硫和硝酸反应的生成物判断是否有沉淀生成;
B.氨气极易溶于水生成氨水,铝离子和氨水能反应生成氢氧化铝;
C.氨气和二氧化碳、水以及氯化钠反应可生成碳酸氢钠;
D.根据一氧化碳和氧气的反应条件分析判断能否生成二氧化碳.
解答 解:A.二氧化氮易溶于水生成硝酸,硝酸有强氧化性,二氧化硫有还原性,所以二氧化硫能被硝酸氧化成硫酸,硫酸和氯化钡发生复分解反应生成白色硫酸钡沉淀,故A不选;
B.氨气极易溶于水生成氨水,氨水能分解生成氢氧根离子,氢氧根离子和铝离子反应生成氢氧化铝沉淀,氢氧化铝能溶于强碱但不溶于弱碱,所以一定有白色沉淀生成,故B不选;
C.类似侯氏制碱法,反应生成碳酸氢钠晶体,故C不选;
D.点燃条件下,一氧化碳能在氧气中燃烧生成二氧化碳,但如果没有点燃条件,一氧化碳和氧气混合不反应,一氧化碳和氧气也不和氢氧化钙反应,所以一定没有沉淀生成,故D选;
故选D.
点评 本题综合考查元素化合物知识,侧重于学生的分析能力、实验能力和元素化合物知识的综合运用的考查,为高频考点,注意二氧化碳和二氧化硫都不与氯化钙反应生成白色沉淀,即弱酸不能制取强酸,难度不大.

练习册系列答案
相关题目
13.(1)镍氢碱性充电电池被誉为“绿色化学电源”,充、放电时的反应:2Ni(OH)2 $?_{放电}^{充电}$2NiO(OH)+H2.放电时,正极的电极反应式为NiOOH+e-+H2O=Ni(OH)2+OH-,充电时,该电极应与电源的正(填“正”或“负”)极相连.
(2)氨在空气中燃烧,生成水和氮气.已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,2H2(g)+O2(g)═2H2O(l)△H=-572kJ•mol-1.则氨在空气中燃烧生成液态水和氮气时的热化学方程式为:4NH3(g)+3O2(g)=2N2(g)+6H2O(l);△H=-1531.2kJ•mol-1.
(3)研究表明工业上合成氨反应(N2(g)+3H2(g)?2NH3(g))在容积固定的密闭容器中发生上述反应,表中为各物质在不同时刻的浓度.
0~5min,H2的平均反应速率vH2=0.072mol/(L•min).反应在5分钟时,条件发生了改变,改变的条件可能是c(填序号).
a.增加氢气的浓度 b.降低温度 c.使用催化剂 d.分离出NH3.
(2)氨在空气中燃烧,生成水和氮气.已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,2H2(g)+O2(g)═2H2O(l)△H=-572kJ•mol-1.则氨在空气中燃烧生成液态水和氮气时的热化学方程式为:4NH3(g)+3O2(g)=2N2(g)+6H2O(l);△H=-1531.2kJ•mol-1.
(3)研究表明工业上合成氨反应(N2(g)+3H2(g)?2NH3(g))在容积固定的密闭容器中发生上述反应,表中为各物质在不同时刻的浓度.
| 时间/min | C(N2)/mol.L-1 | C(H2)/mol.L-1 | C(NH3)/mol.L-1 |
| 0 | 0.6 | 1.8 | 0 |
| 5 | 0.48 | X | 0.24 |
| 10 | 0.26 | 0.78 | 0.68 |
a.增加氢气的浓度 b.降低温度 c.使用催化剂 d.分离出NH3.
10.下列实验操作中正确的是( )
| A. | 应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 分液操作时,下层液体从分液漏斗下口放出后再将上层液体从下口放出到另一个烧杯中 | |
| C. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| D. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
17.下列离子方程式正确的是( )
| A. | 稀硫酸滴在铜片上 Cu+2H+=Cu2++H2↑ | |
| B. | 氢氧化镁与盐酸的反应 H++OH-=H2O | |
| C. | 澄清石灰水与盐酸的反应 Ca(OH)2+2H+=Ca2++2H2O | |
| D. | 碳酸钙溶于稀盐酸中 CaCO3+2H+=Ca2++H2O+CO2↑ |
7.价电子排布式为5s25p3的元素是( )
| A. | 第五周期第ⅢA族 | B. | 51号元素 | C. | sp区的主族元素 | D. | Te |
14.实验室由海水获得淡水的实验装置是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
11.下列物质属于同素异形体的是( )
| A. | 氕、氘、氚 | B. | 甲酸和乙酸 | ||
| C. | 金刚石与石墨 | D. | CH3CH2CH2CH3和CH(CH3)3 |
12.下列说法正确的是(NA表示阿伏加德罗常数的值)( )
| A. | 11.2 L N2含有的分子数为0.5NA | |
| B. | 在常温常压下,1 mol Ne含有的原子数为NA | |
| C. | 71 g Cl2所含分子数为2NA | |
| D. | 在同温同压下,相同体积的任何气体单质所含的原子数相同 |