题目内容
10.在室温下,100ml 0.1mol/L的醋酸溶液中,欲使其溶液的pH值减小,但又要使醋酸电离程度减少,应采取( )| A. | 加入少量CH3COONa固体 | B. | 通入少量氯化氢气体 | ||
| C. | 提高温度 | D. | 加入少量水 |
分析 醋酸是弱电解质,要使溶液溶液的pH减小,可以采取升高温度、加入酸的方法;如果使其电离程度减小,则平衡向正反应方向移动,可以向溶液中加入含有氢离子或醋酸根离子的物质,二者结合分析解答.
解答 解:A.向溶液中加入醋酸钠固体,醋酸根离子浓度增大,抑制醋酸电离,溶液中氢离子浓度减小,溶液pH增大,故A错误;
B.向溶液中通入氯化氢气体,氯化氢电离出氢离子导致溶液中氢离子浓度增大,溶液的pH减小,同时抑制醋酸电离,故B正确;
C.升高温度促进醋酸电离,醋酸电离程度增大,溶液中氢离子浓度增大,pH减小,故C错误;
D.加入水促进醋酸电离,醋酸电离程度增大,故D错误;
故选B.
点评 本题考查了弱电解质电离影响因素,明确哪些条件促进醋酸电离哪些条件抑制醋酸电离是解本题关键,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
Na2O2(s)+CO2(g)=Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
| A. | CO的燃烧热为283 kJ | |
| B. |  如图可表示由CO生成CO2的反应过程和能量关系 | |
| C. | 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>-452 kJ/mol | |
| D. | CO(g)与Na2O2(s)反应放出509 kJ热量时,生成53gNa2CO3(s) |
18.下列关于化学键的说法中,正确的是( )
| A. | 离子键就是阴、阳离子间的静电引力 | |
| B. | 共价化合物中只含有共价键 | |
| C. | 一个阳离子只可与一个阴离子之间存在离子键 | |
| D. | 金属元素和非金属元素化合一定形成离子键 |
5.将-CH3、-OH、-COOH、 四种原子团两两结合,所得化合物水溶液呈酸性的共有( )
四种原子团两两结合,所得化合物水溶液呈酸性的共有( )
 四种原子团两两结合,所得化合物水溶液呈酸性的共有( )
四种原子团两两结合,所得化合物水溶液呈酸性的共有( )| A. | 3种 | B. | .4种 | C. | .5种 | D. | .6种 |
15. 水是生命之源,2014年我国科学家首次拍摄到水分子团簇的空间取向图象,模型如图所示,下列关于水的说法正确的是( )
水是生命之源,2014年我国科学家首次拍摄到水分子团簇的空间取向图象,模型如图所示,下列关于水的说法正确的是( )
 水是生命之源,2014年我国科学家首次拍摄到水分子团簇的空间取向图象,模型如图所示,下列关于水的说法正确的是( )
水是生命之源,2014年我国科学家首次拍摄到水分子团簇的空间取向图象,模型如图所示,下列关于水的说法正确的是( )| A. | 水是弱电解质,某温度下,纯水的pH=6,则说明显酸性 | |
| B. | 可燃冰是可以燃烧的水 | |
| C. | 在相同温度下,水的电离常数与水的离子积常数相等 | |
| D. | 在水中加入Na或NaH,都将促进水的电离 |
20.在一定温度下的恒容容器中进行反应:A(g)+2B(g)?C(g)+D(g),当下列哪些物理量不再发生变化时,能表明该可逆反应已达到平衡状态的是( )
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④混合气体总体积
⑤混合气体总物质的量 ⑥混合气体的平均相对分子质量 ⑦混合气体总质量.
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④混合气体总体积
⑤混合气体总物质的量 ⑥混合气体的平均相对分子质量 ⑦混合气体总质量.
| A. | ①③⑤⑥ | B. | ①②④⑦ | C. | ①②③④⑤⑥⑦ | D. | ①②③④⑤ |
17.下列物质在常温下发生水解时,对应的水解方程式正确的是( )
| A. | K2CO3:CO${\;}_{3}^{2-}$+2H20?H2CO3+OH- | B. | Ca(ClO)2:ClO-+H2O=HClO+OH- | ||
| C. | Ba(HCO3)2:HCO3-+H2O?H3O++CO32- | D. | Na2SO3:SO32-+H2O?HSO3-+OH- |
 (1)发射卫星可用气态肼为燃料,肼的分子式为N2H4,肼的电子式为
(1)发射卫星可用气态肼为燃料,肼的分子式为N2H4,肼的电子式为 .
. .一定量的该气体反应过程的能量变化如图所示,该反应为放热 (填“放热”或“吸热”)反应.25℃,101kPa时,1mol该气体在氧气中燃烧放出热量为akJ,该气体燃烧的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-aKJ/mol.
.一定量的该气体反应过程的能量变化如图所示,该反应为放热 (填“放热”或“吸热”)反应.25℃,101kPa时,1mol该气体在氧气中燃烧放出热量为akJ,该气体燃烧的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-aKJ/mol.
 +(2n-1)H2O.
+(2n-1)H2O. .
.
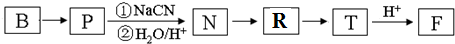
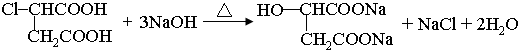 .
.