题目内容
20. 量取16.0mL 10.0mol•L-1HCl溶液,加蒸馏水稀释至100mL,取两份稀释后的HCl溶液各25mL,分别加入等质量的Mg和Al,相同条件下充分反应,产生氢气的体积随时间变化的曲线如图所示(氢气体积已折算成标准状况下的体积),请计算:
量取16.0mL 10.0mol•L-1HCl溶液,加蒸馏水稀释至100mL,取两份稀释后的HCl溶液各25mL,分别加入等质量的Mg和Al,相同条件下充分反应,产生氢气的体积随时间变化的曲线如图所示(氢气体积已折算成标准状况下的体积),请计算:(1)稀释后HCl溶液的物质的量浓度为1.60mol•L-1.
(2)加入Al的质量至少有0.48g.
分析 (1)HCl溶液各25mL,分别加入等质量的Mg和Al,生成的氢气的体积相同,由于Al的电子摩尔质量比Mg的大,所以Al与盐酸反应时Al过量,其反应方程式为:2Al+6HCl=2AlCl3+3H2↑,根据生成的氢气求出盐酸的物质的量和浓度;
(2)Zn与硫酸反应时锌完全反应,根据方程式Zn+H2SO4=ZnSO4+H2↑计算Zn的物质的量和质量,Zn和Fe的质量相同.
解答 解:(1)HCl溶液各25mL,分别加入等质量的Mg和Al,生成的氢气的体积相同,由于Al的电子摩尔质量比Mg的大,所以Al与盐酸反应时Al过量,其反应方程式为:2Al+6HCl=2AlCl3+3H2↑,由图象可知生成的氢气为n(H2)=$\frac{V}{{V}_{m}}$=$\frac{0.448L}{22.4L/mol}$=0.02mol,则n(HCl)=2n(H2)=0.04mol,c(HCl)=$\frac{n}{V}$=$\frac{0.04mol}{0.025L}$=1.60mol/L,
故答案为:1.60;
(2)Mg与盐酸反应时镁完全反应,反应方程式为Mg+2HCl=MgCl2+H2↑,则n(Mg)=0.02mol,m(Mg)=nM=0.02mol×24g/mol=0.48g,Mg和Al的质量相同,所以Al的质量为0.48g,
故答案为:0.48g.
点评 本题考查了根据方程式的计算,明确物质之间发生的反应是解本题关键,再结合原子守恒进行计算,题目难度中等.

练习册系列答案
相关题目
10.下列实验结论不正确的是( )
| 实验操作 | 现象 | 结论 | |
| A | 食醋浸泡水垢 | 产生无色气体 | 乙酸的酸性比碳酸强 |
| B | 乙醇与橙色酸性重铬酸钾溶液混合 | 橙色溶液变为绿色 | 乙醇具有还原性 |
| C | 碘酒滴到土豆片上 | 土豆片变蓝 | 淀粉遇碘变蓝 |
| D | 向甲苯中滴入适量浓溴水,振荡,静置 | 溶液上层呈橙红色,下层几乎无色 | 甲苯和溴发生取代反应,使溴水褪色 |
| A. | A | B. | B | C. | C | D. | D |
11.ClO2是一种消毒杀菌效率高、二次污染小的水处理剂,根据世界环保联盟的要求,ClO2将逐渐取代Cl2成为生产自来水的消毒剂.工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得.有关该反应的说法正确的是( )
| A. | NaClO3在反应中失去电子 | |
| B. | Na2SO3在反应中被还原为Na2SO4 | |
| C. | 在该反应中,NaClO3和Na2SO3的物质的量之比为2:1 | |
| D. | 1 mol NaClO3参加反应有2 mol 电子转移 |
8.可逆反应达到最大反应限度的本质特征是( )
| A. | 反应停止了 | B. | 正逆反应的速率均为零 | ||
| C. | 正逆反应都还在继续进行 | D. | 正逆反应的速率相等 |
15.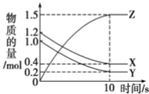 一定温度下,在0.5L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,10s时达到化学平衡状态.则从反应开始到10s末的反应速率用X表示是( )
一定温度下,在0.5L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,10s时达到化学平衡状态.则从反应开始到10s末的反应速率用X表示是( )
 一定温度下,在0.5L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,10s时达到化学平衡状态.则从反应开始到10s末的反应速率用X表示是( )
一定温度下,在0.5L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,10s时达到化学平衡状态.则从反应开始到10s末的反应速率用X表示是( )| A. | 0.08mol•L-1•s-1 | B. | 0.30mol•L-1•s-1 | C. | 0.16mol•L-1•s-1 | D. | 0.32mol•L-1•s-1 |
5.下列说法正确的是( )
| A. | 淀粉和纤维素都可以用(C6H10O5)n表示,所以二者属于同分异构体 | |
| B. | 蛋白质溶液中加入重金属盐而凝聚,但蛋白质不会失去生理活性 | |
| C. | 油脂的皂化反应是在碱性条件下发生水解反应 | |
| D. | 所有有机物中都含有官能团 |
12.化学与社会、生活、生产密切相关.对如表现象或事实的解释正确的是( )
| 选项 | 现象或事实 | 解释 |
| A | 用明矾净水 | 明矾具有杀菌消毒的作用 |
| B | 局部地区出现酸雨 | 煤、石油的燃烧产生大量CO2 |
| C | 潮湿环境中的铁制品生锈 | 铁制品中的Fe与空气中的O2直接反应生成Fe2O3 |
| D | “84”消毒液具有漂白性 | “84”消毒液中的NaClO与空气中的CO2反应生成HClO |
| A. | A | B. | B | C. | C | D. | D |
9.下列物质在一定条件下,可与CH4发生化学反应的是( )
①氯气 ②溴水 ③氧气 ④酸性KMnO4溶液.
①氯气 ②溴水 ③氧气 ④酸性KMnO4溶液.
| A. | ①③ | B. | ②③ | C. | ②④ | D. | ①④ |
10. ⅥA 元素的各种性质可归纳整理如下:
ⅥA 元素的各种性质可归纳整理如下:
回答下列问题:
(1)碲(Te)的氧化物分子式是TeO2、TeO3.
(2)硒酸与碲酸酸性较强的是H2SeO4(填化学式).
(3)比较键能:H-S>H-Se(填“>”或“<”).
(4)氢硒酸放在空气中,可能发生反应的化学方程式为2H2Se+O2=2H2O+2Se↓.
(5)如图所示为ⅥA 族元素单质与 H2反应过程中体系温度变化示意图,其中 a、b、c 分别表示 VIA 族中某一元素的单质,如图为相同物质的量的单质与 H2反应过程中的体系温度变化.则:c 代表硒.(均写单质名称)
 ⅥA 元素的各种性质可归纳整理如下:
ⅥA 元素的各种性质可归纳整理如下:| 性质 | 8O | 16S | 34Se | 52Te |
| 单质熔点/℃ | -218.4 | 113 | 271 | 450 |
| 单质沸点/℃ | -183 | 444.6 | 685 | 1390 |
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
(1)碲(Te)的氧化物分子式是TeO2、TeO3.
(2)硒酸与碲酸酸性较强的是H2SeO4(填化学式).
(3)比较键能:H-S>H-Se(填“>”或“<”).
(4)氢硒酸放在空气中,可能发生反应的化学方程式为2H2Se+O2=2H2O+2Se↓.
(5)如图所示为ⅥA 族元素单质与 H2反应过程中体系温度变化示意图,其中 a、b、c 分别表示 VIA 族中某一元素的单质,如图为相同物质的量的单质与 H2反应过程中的体系温度变化.则:c 代表硒.(均写单质名称)