题目内容
已知:2Fe3++2I-=2Fe2++I2.在含有n molFeI2的溶液中通入Cl2,有x molCl2发生反应,试回答下列问题:
(1)当反应的离子方程式为:2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-时,x与n的关系为
(2)当x≤n时,反应的离子方程式为
(3)当Fe2+和I-两种离子-同时被氧化时,x与n的关系为
(4)x=n时,反应后氧化产物的物质的量为
(1)当反应的离子方程式为:2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-时,x与n的关系为
x≥1.5n
x≥1.5n
;(2)当x≤n时,反应的离子方程式为
2I-+Cl2=2Cl-+I2
2I-+Cl2=2Cl-+I2
;(3)当Fe2+和I-两种离子-同时被氧化时,x与n的关系为
x>n
x>n
;(4)x=n时,反应后氧化产物的物质的量为
n或x
n或x
mol.分析:(1)向FeI2溶液中通入氯气,氯气先和碘离子发生置换反应,然后再和亚铁离子发生反应,根据氯气和FeI2反应的离子方程式确定x与n的关系;
(2)n molFeI2的溶液中通入Cl2,有x molCl2发生反应,当x≤n时,氯气只能氧化碘离子;
(3)氯气先和碘离子发生置换反应,然后再和亚铁离子发生反应,所以当Fe2+和I-两种离子-同时被氧化时,x>n;
(4)当x=n时,只能氧化碘离子,根据2I-+Cl2=2Cl-+I2方程式计算可解;
(2)n molFeI2的溶液中通入Cl2,有x molCl2发生反应,当x≤n时,氯气只能氧化碘离子;
(3)氯气先和碘离子发生置换反应,然后再和亚铁离子发生反应,所以当Fe2+和I-两种离子-同时被氧化时,x>n;
(4)当x=n时,只能氧化碘离子,根据2I-+Cl2=2Cl-+I2方程式计算可解;
解答:解:向FeI2溶液中通入氯气,氯气先和碘离子发生置换反应2I-+Cl2=2Cl-+I2,然后再和亚铁离子发生反应2Fe2++Cl2=Fe3++2Cl-;所以在含有n molFeI2的溶液中通入Cl2,有x molCl2发生反应,
当
≥
时,碘离子、二价铁离子全部被氧化;
≤1时,只能氧化碘离子;1<
<
时,既氧化全部碘离子,又氧化部分二价铁离子.
(1)当反应的离子方程式为:2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-时,由方程式可知:当参加反应的FeI2为2mol时,通入的氯气为3mol,此时碘离子、二价铁离子全部被氧化,氯气可以过量,所以,在含有n molFeI2的溶液中通入x molCl2,x与n的关系为
≥
,即x≥1.5n,
故答案为:x≥1.5n;
(2)因2Fe3++2I-=2Fe2++I2,碘离子的还原性强于二价铁离子,当x≤n时,氯气只能氧化碘离子,发生的反应为2I-+Cl2=2Cl-+I2,
故答案为:2I-+Cl2=2Cl-+I2;
(3)当Fe2+和I-两种离子-同时被氧化时,反应中先氧化全部碘离子,然后剩余的氯气再氧化二价铁离子,x>n,
故答案为:x>n;
(4)x=n时,反应中先氧化全部碘离子,n molFeI2的溶液中含有2nmol的碘离子,所以只氧化碘离子,2I-+Cl2=2Cl-+I2,消耗nmol氯气,生成n或xmol的碘单质;
故答案为:n或x;
当
| x |
| n |
| 3 |
| 2 |
| x |
| n |
| x |
| n |
| 3 |
| 2 |
(1)当反应的离子方程式为:2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-时,由方程式可知:当参加反应的FeI2为2mol时,通入的氯气为3mol,此时碘离子、二价铁离子全部被氧化,氯气可以过量,所以,在含有n molFeI2的溶液中通入x molCl2,x与n的关系为
| x |
| n |
| 3 |
| 2 |
故答案为:x≥1.5n;
(2)因2Fe3++2I-=2Fe2++I2,碘离子的还原性强于二价铁离子,当x≤n时,氯气只能氧化碘离子,发生的反应为2I-+Cl2=2Cl-+I2,
故答案为:2I-+Cl2=2Cl-+I2;
(3)当Fe2+和I-两种离子-同时被氧化时,反应中先氧化全部碘离子,然后剩余的氯气再氧化二价铁离子,x>n,
故答案为:x>n;
(4)x=n时,反应中先氧化全部碘离子,n molFeI2的溶液中含有2nmol的碘离子,所以只氧化碘离子,2I-+Cl2=2Cl-+I2,消耗nmol氯气,生成n或xmol的碘单质;
故答案为:n或x;
点评:本题以氯气和碘化亚铁的反应为载体考查了氧化还原反应,明确溶液中离子反应的先后顺序是解本题的关键,采用极值讨论法来分析解答较简便,题目难度中等.

练习册系列答案
相关题目
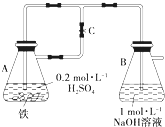 (1)如下图所示,当容器A中的反应开始后,若分别进行下列操作,请回答有关问题:
(1)如下图所示,当容器A中的反应开始后,若分别进行下列操作,请回答有关问题: