题目内容
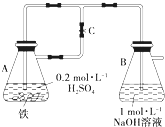 (1)如下图所示,当容器A中的反应开始后,若分别进行下列操作,请回答有关问题:
(1)如下图所示,当容器A中的反应开始后,若分别进行下列操作,请回答有关问题:①若弹簧夹C打开,B容器中有什么现象发生?
②若开始时弹簧夹C关闭,容器A中的反应还在进行时,B容器中有什么现象发生?写出B容器中有关反应的化学方程式.
③若先打开弹簧夹C一段时间,容器A中的反应还在进行时,再关闭弹簧夹C一会儿,B容器中有什么现象发生?
(2)已知:2Fe3++2I-═2Fe2++I2,2Fe2++Br2═2Fe3++2Br-.
①含有1mol FeI2和2mol FeBr2的溶液中通入2mol Cl2,此时被氧化的离子是
②如果向原溶液中通入3mol Cl2,则被氧化的离子是
③若向含a mol FeI2和b mol FeBr2的溶液中通入c mol Cl2,当I-、Fe2+、Br-完全被氧化时,c为
分析:(1)①打开C后铁与稀硫酸反应生成的氢气会加入装置B;
②关闭C后,A中压强增大,A中的硫酸亚铁溶液进入B,反应生成氢氧化亚铁,氢氧化亚铁与氧气反应生成红褐色的氢氧化铁,据此进行解答;
③打开C后铁与硫酸反应生成氢气,关闭C后A中压强增大,硫酸亚铁溶液进入B,反应生成氢氧化亚铁白色沉淀;
(2)根据方程式知,还原性强弱顺序是:I->Fe2+>Br-,向溶液中通入氯气,氯气先和碘离子反应,然后再和亚铁离子反应,最后再和溴离子反应,据此碘化亚铁、溴化亚铁的物质的量及氯气的物质的量进行分析、计算即可.
②关闭C后,A中压强增大,A中的硫酸亚铁溶液进入B,反应生成氢氧化亚铁,氢氧化亚铁与氧气反应生成红褐色的氢氧化铁,据此进行解答;
③打开C后铁与硫酸反应生成氢气,关闭C后A中压强增大,硫酸亚铁溶液进入B,反应生成氢氧化亚铁白色沉淀;
(2)根据方程式知,还原性强弱顺序是:I->Fe2+>Br-,向溶液中通入氯气,氯气先和碘离子反应,然后再和亚铁离子反应,最后再和溴离子反应,据此碘化亚铁、溴化亚铁的物质的量及氯气的物质的量进行分析、计算即可.
解答:解:(1)①打开C,A中Fe与稀H2SO4反应生成H2,A中压强增大,气体通过导管进入B,B中有气泡冒出,
答:若弹簧夹C打开,容器B中的导管口有气泡冒出;
②若开始关闭C,A中反应生成H2,压强增大,A中溶液由导管进入B,B中Fe2+与OH-反应生成Fe(OH)2白色沉淀,Fe(OH)2与B中O2反应生成红褐色沉淀Fe(OH)3,反应的化学方程式为:2NaOH+FeSO4═Fe(OH)2↓+Na2SO4、4Fe(OH)2+O2+2H2O═4Fe(OH)3,
故答案为:容器A中溶液进入容器B,容器B中有白色沉淀生成,沉淀迅速变为灰绿色,最后变成红褐色;2NaOH+FeSO4═Fe(OH)2↓+Na2SO4、4Fe(OH)2+O2+2H2O═4Fe(OH)3;
③若先打开C,H2进入B,驱出B中O2,再关闭C,A中Fe2+进入B,只能生成Fe(OH)2,
答:B容器中现象为:开始时容器B中的导管口有气泡冒出,弹簧夹关闭后容器A中溶液进入容器B,有白色沉淀生成;
(2)①向含有1mol FeI2和2mol FeBr2的溶液中通入2mol Cl2,先发生反应2I-+Cl2=I2+2Cl-,2mol碘离子完全反应需要氯气1mol,然后发生反应Cl2+2Fe 2+=2Cl-+2Fe3+,1mol氯气反应需要亚铁离子的物质的量是2mol,溶液中含有3mol亚铁离子,参加反应的亚铁离子的物质的量是2mol,所以溶液中还剩余亚铁离子1mol,所以被氧化的离子是2molI-、2molFe 2+,
故答案为:I-、Fe 2+;2mol、2mol;
②向含有1mol FeI2和2mol FeBr2的溶液中通入3mol Cl2,先发生反应2I-+Cl2=I2+2Cl-,2mol碘离子完全反应需要氯气1mol,然后发生反应Cl2+2Fe 2+=2Cl-+2Fe3+,溶液中含有3mol亚铁离子,亚铁离子完全被氧化,则需要氯气的物质的量是1.5mol,最后发生2Br-+Cl2=Br2+2Cl-,溴离子的物质的量是3mol,则需要氯气的物质的量是1.5mol,实际上还有0.5mol氯气,则被氧化的溴离子的物质的量是1mol,所以溶液中还剩下0.5mol溴离子,则被氧化的离子及物质的量为:2molI-、3molFe2+、1molBr-,对应的氧化产物分别是1molI2、3molFe 3+、0.5molBr2,
故答案为:I-、Fe2+、Br-;1mol、3mol、0.5mol;
③a mol FeI2和b mol FeBr2的溶液中总共含有(a+b)molFe2+、2amolI-、2bBr-,根据反应方程式:2I-+Cl2=I2+2Cl-、Cl2+2Fe 2+=2Cl-+2Fe3+、2Br-+Cl2=Br2+2Cl-可知,消耗的氯气的物质的量为:
×(a+b+2a+2b)mol=
mol,
故答案为:
.
答:若弹簧夹C打开,容器B中的导管口有气泡冒出;
②若开始关闭C,A中反应生成H2,压强增大,A中溶液由导管进入B,B中Fe2+与OH-反应生成Fe(OH)2白色沉淀,Fe(OH)2与B中O2反应生成红褐色沉淀Fe(OH)3,反应的化学方程式为:2NaOH+FeSO4═Fe(OH)2↓+Na2SO4、4Fe(OH)2+O2+2H2O═4Fe(OH)3,
故答案为:容器A中溶液进入容器B,容器B中有白色沉淀生成,沉淀迅速变为灰绿色,最后变成红褐色;2NaOH+FeSO4═Fe(OH)2↓+Na2SO4、4Fe(OH)2+O2+2H2O═4Fe(OH)3;
③若先打开C,H2进入B,驱出B中O2,再关闭C,A中Fe2+进入B,只能生成Fe(OH)2,
答:B容器中现象为:开始时容器B中的导管口有气泡冒出,弹簧夹关闭后容器A中溶液进入容器B,有白色沉淀生成;
(2)①向含有1mol FeI2和2mol FeBr2的溶液中通入2mol Cl2,先发生反应2I-+Cl2=I2+2Cl-,2mol碘离子完全反应需要氯气1mol,然后发生反应Cl2+2Fe 2+=2Cl-+2Fe3+,1mol氯气反应需要亚铁离子的物质的量是2mol,溶液中含有3mol亚铁离子,参加反应的亚铁离子的物质的量是2mol,所以溶液中还剩余亚铁离子1mol,所以被氧化的离子是2molI-、2molFe 2+,
故答案为:I-、Fe 2+;2mol、2mol;
②向含有1mol FeI2和2mol FeBr2的溶液中通入3mol Cl2,先发生反应2I-+Cl2=I2+2Cl-,2mol碘离子完全反应需要氯气1mol,然后发生反应Cl2+2Fe 2+=2Cl-+2Fe3+,溶液中含有3mol亚铁离子,亚铁离子完全被氧化,则需要氯气的物质的量是1.5mol,最后发生2Br-+Cl2=Br2+2Cl-,溴离子的物质的量是3mol,则需要氯气的物质的量是1.5mol,实际上还有0.5mol氯气,则被氧化的溴离子的物质的量是1mol,所以溶液中还剩下0.5mol溴离子,则被氧化的离子及物质的量为:2molI-、3molFe2+、1molBr-,对应的氧化产物分别是1molI2、3molFe 3+、0.5molBr2,
故答案为:I-、Fe2+、Br-;1mol、3mol、0.5mol;
③a mol FeI2和b mol FeBr2的溶液中总共含有(a+b)molFe2+、2amolI-、2bBr-,根据反应方程式:2I-+Cl2=I2+2Cl-、Cl2+2Fe 2+=2Cl-+2Fe3+、2Br-+Cl2=Br2+2Cl-可知,消耗的氯气的物质的量为:
| 1 |
| 2 |
| 3a+3b |
| 2 |
故答案为:
| 3a+3b |
| 2 |
点评:本题考查了氧化还原反应的有关计算,根据离子还原性强弱顺序、氧化还原反应中得失电子相等来分析解答,易错题是(2)②,注意氧化产物中含有被氧化离子的数目.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目