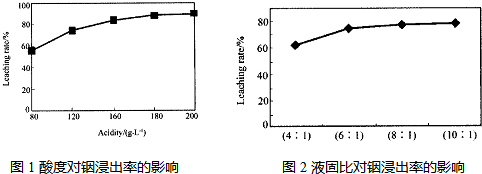
题目内容
(10分)已知:2Fe3++2I-===2Fe2++I2,2Fe2++Br2===2Fe3++2Br-。
(1)含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此时被氧化的离子是____________,被氧化的离子的物质的量分别是________。
(2)如果向原溶液中通入3 mol Cl2,则被氧化的离子是________,其对应的氧化产物的物质的量分别是________。
(3)若向含a mol FeI2和b mol FeBr2的溶液中通入c mol Cl2,当I-、Fe2+、Br-完全被氧化时,c为________(用含a、b的代数式表示)。
【答案】
( 10分,每空2分)
①I-、Fe2+ 2 mol、2 mol
②I-、Fe2+、Br- 1 mol、3 mol、0.5 mol ③
【解析】考查氧化还原反应的应该判断和计算。
(1)在氧化还原反应中还原剂的还原性强于还原产物的,所以还原性强弱顺序是I-、Fe2+、Br-,所以氯气首先氧化的的是I-,然后是Fe2+,最后是Br-。根据电子的得失守恒可知,2mol氯气能氧化2molI-和2molFe2+。
(2)如果氯气是3mol,则根据电子的得失守恒可知,被氧化的离子是2molI-、3molFe2+和1molBr-,所以对应的氧化产物分别是1molI2、3molFe3+和0.5molBr2。
(3)根据电子的得失守恒可知,2c=2a+(a+b)+2b,即c= 。
。

练习册系列答案
相关题目

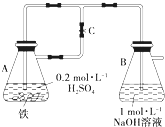 (1)如下图所示,当容器A中的反应开始后,若分别进行下列操作,请回答有关问题:
(1)如下图所示,当容器A中的反应开始后,若分别进行下列操作,请回答有关问题: